【藥事論壇】高價、新興藥品及罕藥支付現況與挑戰暨企業參訪
- 日 期:2023-11-10
- 地 點:三軍總醫院內湖院區 B1 演講廳
- 主辦單位:社團法人台灣藥物品質協會
- 聯 絡 人:潘小姐
- 聯絡 Email:[email protected]
- 電 話:02-87923100ext.18176
- 活動網址
活動介紹
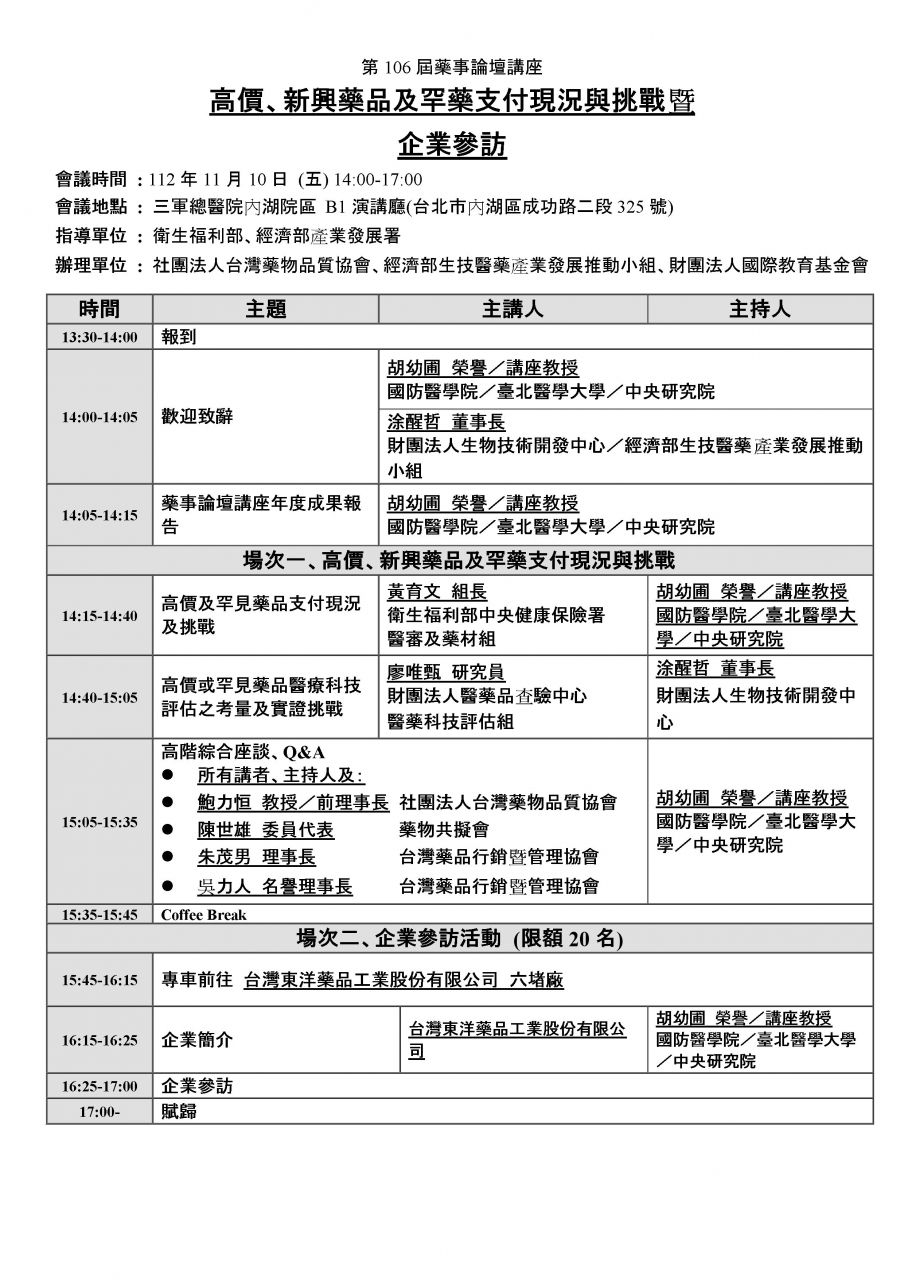
第 106 屆藥事論壇講座
高價、新興藥品及罕藥支付現況與挑戰暨企業參訪
日期:112 年 11 月 10 日 (五) 14:00-17:00
地點:三軍總醫院內湖院區 B1 演講廳 (實體/視訊同步)
指導單位 : 衛生福利部、經濟部工業局
辦理單位 : 社團法人台灣藥物品質協會、經濟部生技醫藥產業發展推動小組、財團法人國際教育基金會
第 106 屆藥事論壇講座 將於 112 年 11 月 10 日 (星期五) 14:00-17:00 辦理「高價、新興藥品及罕藥支付現況與挑戰暨企業參訪」論壇。
場次一、高價、新興藥品及罕藥支付現況與挑戰
除了傳統的藥物之外,近年來「基因/細胞治療」等新興療法、罕見疾病藥物開發,為許多病患者提供了新的治療選擇。然而,部分新藥的昂貴價格,讓無力負擔的患者難以受惠。
2022 年 11 月美國 FDA 核准一款治療血友病的新藥 Hemgenix,每次療程定價 350 萬美元,當時ICER (The Institute for Clinical and Economic Review) 證實此藥為世界上最昂貴的療法,舉世譁然。
為使罹患罕見疾病患者之國人,能以負擔得起的價格獲得治療,在我國,一針要價 4900 萬元的基因治療藥物「諾健生(Zolgensma)」,於 2023 年 8 月起首度納入衛生福利部中央健康保險署給付,提高脊髓性肌肉萎縮症(SMA)患者的治療品質,創下臺灣健保史上最貴的給付藥物紀錄。然而,並不是所有罹患脊髓性肌肉萎縮症(SMA)患者都符合此藥物的健保給付條件。本次藥事論壇特邀衛生福利部中央健康保險署 醫審及藥材組 黃育文 組長,主講 高價及罕見藥品支付現況及挑戰。政府單位在選擇支付高價、新興藥品及罕藥的主要考量為何?當中面臨哪些挑戰?藉論壇講者之解說,相信能使關心藥價議題者,更進一步瞭解健保給付現況與重點。
隨著新興醫療科技相繼問市,這些藥品或治療的價格,相對於傳統小分子藥品高出許多。考量給付者對於此類型新興高價或罕見藥品之經驗較為缺乏,國際上主要的醫療科技評估組織皆提出相應討論或策略,為各國藥品給付單位或主管機關之高價藥品給付擬定策略。本次論壇將由 財團法人醫藥品查驗中心醫藥科技評估組 廖唯甄 研究員,探討高價或罕見藥品醫療科技評估之考量及實證挑戰,簡介英國 NICE 之 HST 評估指引、澳洲 PBAC 之救援規則主張,及加拿大 CADTH 之評估考量,探討國際上針對高價/罕見藥品之評估和決策流程,以及目前各評估組織及決策者克服證據不足的對策,期有助於我國高價藥品或罕見藥品評估時所遇之挑戰。
藥事論壇講座自民國 93 年開辦 19 年,至今已連續辦理 106 屆,討論與新藥物相關之智財、專利、法規、臨床等藥物研發及藥物法規、管理相關之主題,超過 18,345 位醫藥界與產、官、學、研菁英參與,其中,衛福部新藥審議/諮詢委員、醫藥政官員、CDE 審查員逾 3,897 人次,頗具實際溝通、解決問題及提出願景之效果。
場次二、企業參訪:台灣東洋藥品工業股份有限公司(限額 20 名)
大會另特別安排與會者實地參訪 專注於抗腫瘤、重症及抗感染之研發與創新,提供更完整的疾病治療方案之藥廠 ─ 台灣東洋藥品工業股份有限公司。
台灣東洋藥品在國內擁有三處 cGMP 生產基地,各廠專注製造的產品分別為癌症藥品(中壢廠)、非癌症藥品(六堵廠)和臨床用藥品(內湖廠)。此次參觀之六堵廠,具備口服製劑廠及針劑製劑廠雙產線,皆通過 PIC/S GMP、GDP 查廠合格,能提供穩定且高品質的藥品。
不僅如此,台灣東洋藥品利用豐富的藥物查驗登記經驗,全力支援產品開發計劃,也已能夠自行撰寫通用技術文件(CTD)的模組 2 和 3,即化學製造管制(CMC)文件,且多項抗腫瘤針劑皆已獲得 EMA 核准認證。
期待此次參訪使與會者藉由實地走訪之難得機會,更瞭解藥品開發、製造、行銷三位一體的台灣東洋藥品工業股份有限公司。惟受限於場地及時間因素,此次企業參訪限額 20 名,隨機抽選名單, 欲報從速,以免向隅。
活動議程