mRNA疫苗自2020年10月臨床二期實驗證明有效後,有關mRNA疫苗開發者的報導就傳遍全球,其實mRNA疫苗如果沒有奈米佐劑的傳輸,即運送系統,mRNA疫苗也不會成功,就像太空人再怎麼訓練有素,沒有太空船,也上不了太空一樣。
而mRNA疫苗這次用於感染性疾病的預防,只是牛刀小試,未來,mRNA技術將加入癌症免疫治療行列,這更是全球後疫情時代的生技競爭重點,連Tesla的馬斯克都興奮不已,大力加碼mRNA的投資!
所以,今天我們就花個時間來講講mRNA疫苗的科普,並點出大陸、韓國和新加坡,大力爭取mRNA疫苗代工的背後佈局,期待台灣莫一再錯過世界科技潮流,最後連CDMO都做不成。
台灣及早技轉mRNA疫苗技術的理由
我們先談談台灣必須即早技轉mRNA疫苗技術用於病毒防治的理由:1、mRNA疫苗只要改基因,就能快速應付病毒的變異:
mRNA疫苗主要把病毒的基因在實驗室先設計好,合成好,然後送進人體,剩下就是人體細胞的工作。
這攜帶病毒蛋白質S-protein的基因密碼,進入人體細胞內,會指揮人體細胞合成病毒的S-protein(抗原),然後推送到細胞膜外面,引發免疫細胞注意,進而產生抗體,保護人體,所以mRNA疫苗有製備快速的優點。
目前,mRNA疫苗公司均有基因設計平台,只要換上不同病毒的基因片段,馬上就可以製作新的疫苗出來。這次新冠病毒是RNA病毒,特點就是不斷地變變變,所以,我們會看到新的突變株不斷的出現。
大部份的突變株不見得會造成更大的死亡率,但萬一出現殺傷力特強,或傳播力特強的新款變異株時,mRNA疫苗對付新病毒的反應速度,會比傳統的蛋白質疫苗(如本土國產疫苗)快很多。因為mRNA疫苗只要換上新病毒的基因,就像換上錄音帶卡匣一樣簡單,新疫苗馬上就可上陣,進入臨床測試。而蛋白質疫苗,除了換上基因卡匣,還要在工廠裡面先生產成病毒蛋白質,才可打入人體,進行臨床實驗,這一拖往往就好幾個月。
這時全球有 mRNA疫苗技術者已經有疫苗,可普遍施打,群體免疫了,這會對國際競爭力產生很大的差距。像這次,台灣電子廠商正趕著拼世界超前之際,缺疫苗情勢竟跟缺水、缺電一樣緊張,台灣怎能不事「後」佈署,趕快引進mRNA基因合成技術呢?
2、mRNA疫苗利用人體當工廠,生產時程較蛋白質疫苗快很多:
如前所述,mRNA疫苗把人體當工廠,製程短,製造成本低。蛋白質疫苗則必須在cGMP工廠,用生物反應器,一噸、二噸地日夜趕工生產、純化、去除過敏原…等步驟,工藝程序比mRNA多太多了。
碰到如新冠病毒這類又急又猛的全球性傳染,又是變異快速的RNA病毒,最好的疫苗首選就是mRNA疫苗。其他疫苗,如腺病毒疫苗利用病毒傳輸,雖也不錯,但安全性稍差; 而減毒疫苗須要數代馴化,則太慢; 去活化疫苗容易產生 ADE (Antibody-Dependence-Enhancement Effect)的安全性問題。
所以,mRNA疫苗成為疫苗界的新寵,歐美各國,中國、韓國和新加坡…紛紛爭相競取,欲從取得代工技術,跨入新疫苗領域,台灣不可錯過。
mRNA疫苗技術成功的必要條件
以上為政策眼光的部份,接下來我們來談mRNA疫苗技術成功的必要條件。
首先,我們先聊聊mRNA基因的改良,其次我們來談談如何把這脆弱的基因送進人體細胞,並命令人體細胞合成病毒蛋白質,這有如天方夜壇的神奇過程,怎麼做到的?
而輝瑞疫苗和莫德納疫苗,明明就來自於同一mRNA師祖,運輸和保存條件又怎會差那麼多?
A. mRNA基因的改良,克服了mRNA基因不穩定和易被分解的瓶頸:
疫苗傳輸技術己研究二十多年了,其中包括naked DNA和用腺病毒運送的腺病毒疫苗(即此次的AZ疫苗)…等等。mRNA因為是蛋白質合成中的中繼信使核苷酸分子,壽命短又不穩定,所以一直無法被工業化,直到近年在mRNA基因的穩定性和蛋白質表現量能上,做了很大的改進,大致分為5大部份,因而造就了這次掃除新冠病毒的大任。
圖一:❶❹與mRNA的穩定性(例如抗Nuclease酵素分解)和啓動有關,❷與mRNA的調控和蛋白質表現有關,以上❶❷❹為專利保護區塊,乃商業競爭重點區。目前,全球有7家mRNA公司,各有所長。
而❸為「病毒基序列」區,即上述的卡匣區,這次Covid-19 s-protein基因序列,為公開資訊。未來,如有新變異株,例如兇猛的巴西變異株,就換成巴西株的基因序列,如果要改成癌症疫苗,則換成腫瘤抗原基因。
所以,只要先把這 mRNA疫苗平台做好,未來可常常久久一直開發下去,不會因為疫情退燒而變成無用武之地,這也正是建議台灣要積極爭取技轉的長期理由。
但mRNA疫苗目前蛋白質表現還有改良空間,新一代讓mRNA可源源不斷合成抗原的self-amplifying RNA (saRNA) 技術,已經進入臨床第二期,台灣切莫離世界愈來愈遠。
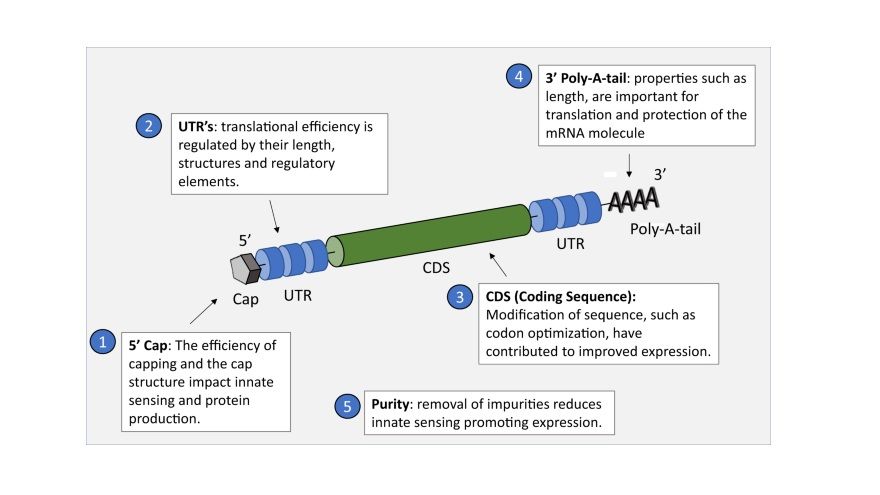
圖一:mRNA疫苗的基因結構重點,圖案來源:mRNA vaccine for cancer immunotherapy Molecular Cancer volume 20, Article number: 41 (2021)
B. mRNA的奈米脂質傳輸才是啓動疫苗成功的背後功臣,也是量產的最大瓶頸:
mRNA是基因片段,如何進入人體,最後引發免疫細胞的注意,進而生產出我們要的抗體呢?
我們要是的是「抗體」,因為只有抗體才能保護我們抵抗新冠病毒。而人體又是如何產生抗體?
人體對外來的細菌和病毒本來就會產生抗體,標準步驟就是(如圖二):病菌進入,被免疫呈現細胞,也就是巡邏兵發現,然後「吞下」(endocytosis)該病菌,分解之,再把病菌碎片推到細胞膜表面,被免疫細胞,如B細胞的前驅細胞發現,最後產生抗體。
所以,mRNA疫苗要成功的第二步,就是"假裝成病菌"的樣子--圓圓的、怪怪的、非我族類的模樣,才會吸引抗原呈現細胞來吞下它。
科學家經過十多年的努力,終於找到最佳脂質配方,一來可以把脆弱的mRNA包起來,給它第二道防護,使其不在血液中被酵素分解,並且可吸引抗原呈現細胞靠近、再靠近一點,最後儘量吃下mRNA,且吃愈多愈好,愈有效率。然後,這些脂質又必須在適當時刻功成身退,在人體細胞質中被分解,並且不可以產生毒素。而能達到諸多目標的配方,就是營業祕密嘍。
可惜,這包住mRNA的脂肪必須在冷凍的狀態才會一粒粒地、完完整整地像一顆顆病菌一樣被吞下。而解凍或常溫後的mRNA脂質粒,就像冰淇淋一樣會溶化成糊狀,因此,這必然會影響疫苗施打後的效率。
莫德納的運輸條件比輝瑞的超低溫冷鏈條件顯然好很多,在-20度C即可運送,冰箱貯存可保存一個月。造成這二款疫苗的運輸差別,其實正是脂質配方的問題,也就是藥學所說的「佐劑配方」的差異,而這差異產生了很多運送成本、不方便性和報廢問題。
而除了配方是專利或營業祕密之外,奈米脂質的包覆難在混合過程相當耗時,須要在低溫用低速度攪拌,力道太強會把好不容易合成的mRNA單鏈基因打斷,另外又要維持脂質的粒徑,太大、太小,我們的細胞都不會去吃它。
所以脂質包覆是整個mRNA疫苗生產上最大的瓶頸(圖三),例如擁有全球mRNA疫苗最大生產廠的輝瑞密西根廠,動用了100台混合機,在低溫下,連續攪拌30個小時,也才生產出300萬劑疫苗而己,而無法量產正是台灣生技過往的弱點,這不是有錢到位就可解決,還是須要研究與經驗。
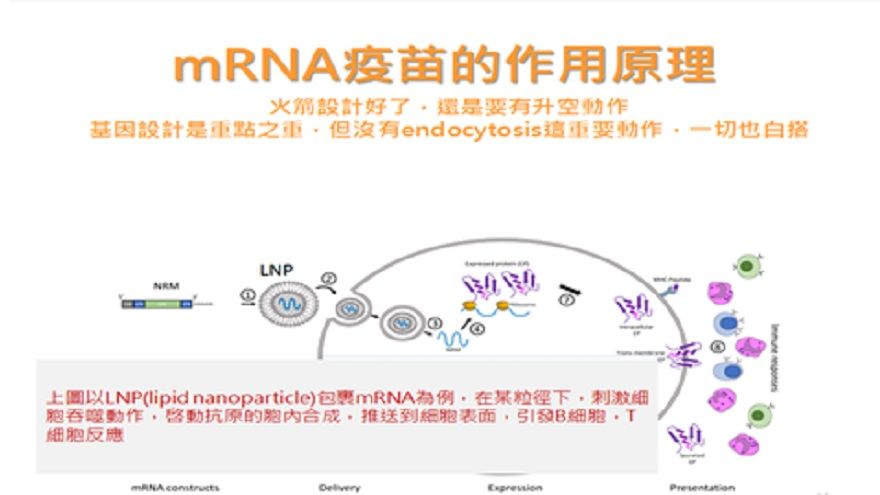
圖二:mRNA疫苗進入人體細胞後,啓動基因合成,在細胞質產生病毒抗原,呈現於細胞膜上,吸引免疫細胞注意,最後生產抗體,抵抗病毒。原圖來源The promise of mRNA vaccines: a biotech and industrial perspective。
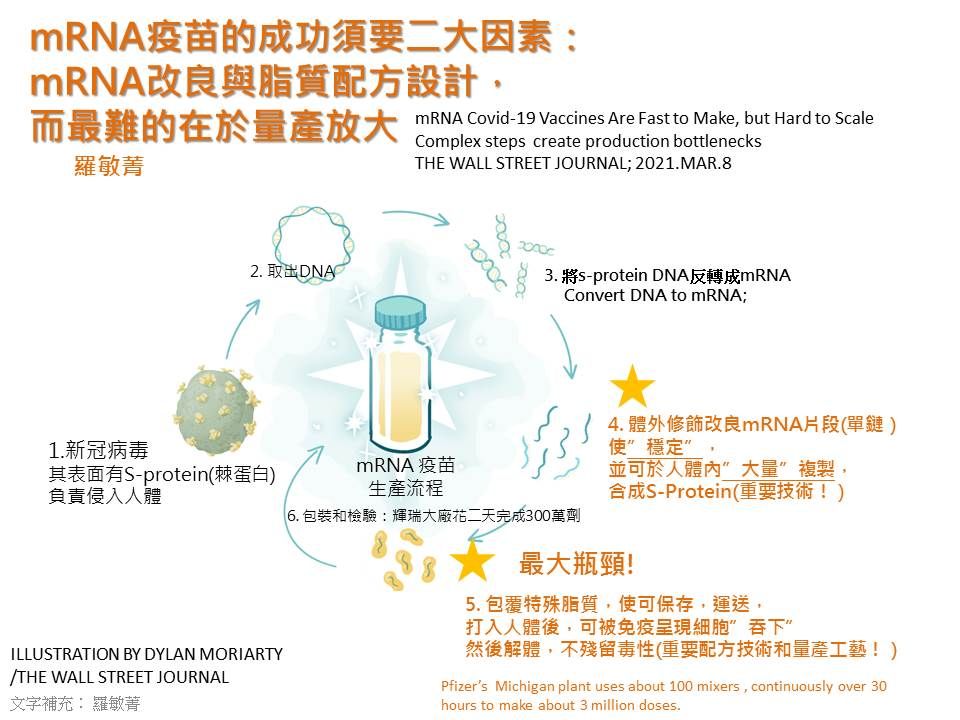
圖三:mRNA疫苗生產流程與瓶頸,圖片來源:The Wall Street Journal, 2021/3/8
以上,簡單描述mRNA疫苗背後的工藝和國際競爭重點。
這次新冠肆虐,不僅加速了mRNA疫苗有效性和安全性的驗證。由於mRNA疫苗可以應用的範圍非常廣泛,Moderna、BioNTech和 Curevac這三大龍頭也都已經互相競爭到癌症治療領域上了,期待台灣這次疫情平息後,能重視mRNA疫苗技術的潛力,趕快追上國際腳步!
主要資料來源:
1、25 February 2021/mRNA vaccine for cancer immunotherapy,Molecular Cancer volume 20, Article number: 41 (2021)
2、04 February 2020 The promise of mRNA vaccines: a biotech and industrial perspective








