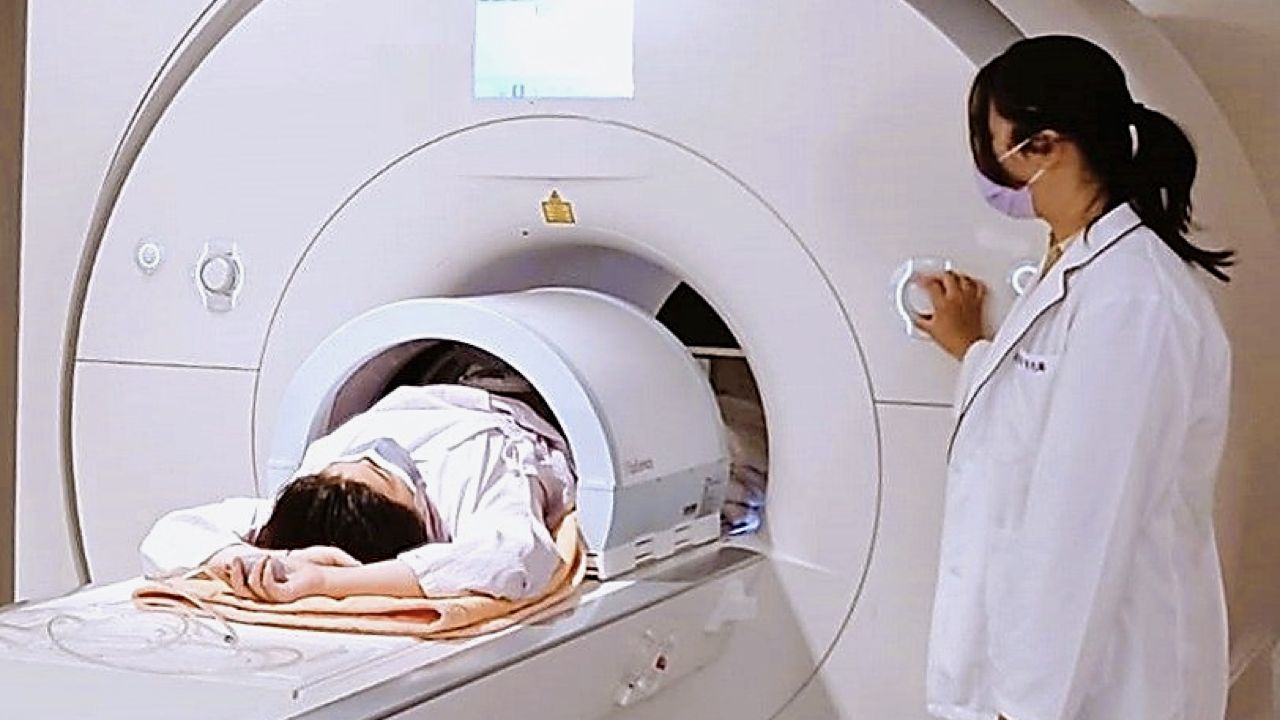
成立於2013年,以超音波為核心技術,發展創新、精準治療的高階醫療器材的振磬科技,其已上市的主力產品--振磬標靶音波刀(ArcBlate MRgHIFU),是一種非侵入式的磁振導引高強度聚焦超音波治療系統,可用於多種軟組織病灶,如腫瘤、神經等的無創熱消融治療,治療過程無傷口、不出血、無輻射。
標靶音波刀結合MRI磁振造影的高解析度3D影像,治療時可精準導引定位,並能即時監控治療區域的溫度,確保治療有效性及安全性。
振磬標靶音波刀也於2023年也獲得臺北生技獎之創新技術金獎肯定。標靶音波刀的創新專利弧形機構設計,還具備便攜式、靈活、低燒灼皮膚風險、成本效益等優勢。
在治療時可快速裝設於現有的MRI床台上,不會改動MRI系統;其上置式聚焦超音波探頭加水袋的設計,探頭可3軸移動定位並調整聚焦深度,提供醫師更廣的治療路徑選擇,病患擺位與操作上更靈活方便。
自然下垂的水袋,則可與患者皮膚緊密接觸,降低超音波因介面空隙或氣泡而釋出熱能燒灼到皮膚的風險;相較另外其他下置式探頭的競品,可大幅縮短整體占用MRI的時間,對醫院端具有更高的成本效益。
振磬科技從國家衛生研究院技轉授權MRgHIFU技術後,經過多年技術改良後,完成標靶音波刀的商品化,並已取得台灣衛福部食藥署(TFDA)核准為第三等級醫材,目前歐盟CE MDR醫材許可證正進行審查中,日前也正進行亞太地區如新加坡、泰國及印尼等地的取證。
標靶音波刀目前已裝設在大林慈濟、花蓮慈濟、亞東、義大等醫院中,針對子宮肌瘤和子宮肌腺症病患提供治療服務。2023年底,也針對第二項適應症-癌症骨轉移減痛治療開始多中心樞紐性臨床試驗的收案,試驗醫院包括台中榮總、亞東、台大與林口長庚等4家醫院。
此種「MRgHIFU非侵入式熱消融治療」,是近年歐美臨床醫療新趨勢,在癌症骨轉移患者進行化療及放療等第一線療法同時,可搭配作為骨轉移減痛治療,提高病患的生活品質。
目前,歐洲也正在進行比較MRgHIFU及體外放射治療用於骨轉移減痛的多中心臨床試驗,希望能將MRgHIFU提升成為癌症骨轉移減痛之第一線療法,並納入健保給付。
振磬藉由持續擴展開發更多的臨床應用來提升產品與公司價值,並規劃從台灣出發,逐步前進亞洲與歐美市場,嘉惠更多腫瘤與癌症患者。
振磬目前正在進行新一輪的募資,透過本次BIO Asia-Taiwan公司說明會,希望能讓潛在客戶及投資人了解振磬的MRgHIFU產品及市場應用,更期望能吸引國際投資人的關注,找到資金及合作夥伴,協助振磬的標靶音波刀推向國際市場。
標靶音波刀結合MRI磁振造影的高解析度3D影像,治療時可精準導引定位,並能即時監控治療區域的溫度,確保治療有效性及安全性。
振磬標靶音波刀也於2023年也獲得臺北生技獎之創新技術金獎肯定。標靶音波刀的創新專利弧形機構設計,還具備便攜式、靈活、低燒灼皮膚風險、成本效益等優勢。
在治療時可快速裝設於現有的MRI床台上,不會改動MRI系統;其上置式聚焦超音波探頭加水袋的設計,探頭可3軸移動定位並調整聚焦深度,提供醫師更廣的治療路徑選擇,病患擺位與操作上更靈活方便。
自然下垂的水袋,則可與患者皮膚緊密接觸,降低超音波因介面空隙或氣泡而釋出熱能燒灼到皮膚的風險;相較另外其他下置式探頭的競品,可大幅縮短整體占用MRI的時間,對醫院端具有更高的成本效益。
國衛院技轉後再優化 望為歐洲癌症骨轉移減痛一線療法
振磬科技從國家衛生研究院技轉授權MRgHIFU技術後,經過多年技術改良後,完成標靶音波刀的商品化,並已取得台灣衛福部食藥署(TFDA)核准為第三等級醫材,目前歐盟CE MDR醫材許可證正進行審查中,日前也正進行亞太地區如新加坡、泰國及印尼等地的取證。
標靶音波刀目前已裝設在大林慈濟、花蓮慈濟、亞東、義大等醫院中,針對子宮肌瘤和子宮肌腺症病患提供治療服務。2023年底,也針對第二項適應症-癌症骨轉移減痛治療開始多中心樞紐性臨床試驗的收案,試驗醫院包括台中榮總、亞東、台大與林口長庚等4家醫院。
此種「MRgHIFU非侵入式熱消融治療」,是近年歐美臨床醫療新趨勢,在癌症骨轉移患者進行化療及放療等第一線療法同時,可搭配作為骨轉移減痛治療,提高病患的生活品質。
目前,歐洲也正在進行比較MRgHIFU及體外放射治療用於骨轉移減痛的多中心臨床試驗,希望能將MRgHIFU提升成為癌症骨轉移減痛之第一線療法,並納入健保給付。
振磬藉由持續擴展開發更多的臨床應用來提升產品與公司價值,並規劃從台灣出發,逐步前進亞洲與歐美市場,嘉惠更多腫瘤與癌症患者。
振磬目前正在進行新一輪的募資,透過本次BIO Asia-Taiwan公司說明會,希望能讓潛在客戶及投資人了解振磬的MRgHIFU產品及市場應用,更期望能吸引國際投資人的關注,找到資金及合作夥伴,協助振磬的標靶音波刀推向國際市場。
【關於振磬科技】
振磬科技成立於2013年,專注於婦女醫學領域,致力開發高科技醫學診斷及影像導航產品,核心優勢為尖端超音波系統及探頭研發技術,成功開發新一代 MRI 與超音波導引聚焦超音波治療系統,提供更先進的無創腫瘤治療技術。
振磬標靶音波刀樞紐試驗首例完成 癌症骨轉移3~5天有效減痛!撰文記者 巫芝岳 日期:2023-12-08 |