美國權威專家預言,因為液體切片問世,癌症篩檢5年內就會成為年度體檢的一個項目。液態切片市場潛力巨大,國際醫藥巨頭和風險投資者早已瞄準這一炙手可熱的領域,JP摩根估計全球市場潛力為230億美元。
文/王柏豪
越來越多研究證實,腫瘤會在病患的血液裡留下線索,且會隨時間改變,這對癌症治療的選擇、治療的監控和追蹤復發,將提供很有價值、有系統的醫療指導,這種有別於傳統侵入性切片的「液態切片」(Liquid Biopsy),已經逐漸為醫界接受。
液態切片可以隨時監控癌症,也可以找到最適合的治療方式。和傳統組織切片一樣,液態切片可藉由全基因檢測,幫助腫瘤科醫師選擇合適的、較少副作用的標靶藥物。
2016年上半年,台灣高醫癌症中心就檢測了60例肺腺癌末期病人,藉由醫院研發的「液態生物檢體」肺癌基因檢測,只要病患抽血10 cc就能檢測出是否為「T790M」基因突變,以決定是否使用第三代標靶藥物治療延長壽命。
末期肺腺癌病人約6成有表皮生長因子受體(EGFR)致癌基因突變,可先使用標靶藥物治療,但平均1年就會產生抗藥性,致使第一、二代標靶藥無效,而這些病人當中,有6成是T790M突變,目前已有第三代標靶藥物可治療(台灣尚未上市),可延長存活期1年。
經檢測結果,在25例曾受檢有突變的病患中,發現有11例出現T790M基因突變,高醫為這些病友申請適用衛福部核准的「恩慈療法」。患者不用付費,目前已申請通過5人,已有3人開始服用第三代標靶藥物,是末期肺腺癌病友一大福音。
美國學研界公認的基因與癌症權威科學家--約翰霍普金斯大學金墨爾癌症中心(Johns Hopkins Kimmel Cancer Center)的癌症生物學副主任Victor Velculescu預言:「這是革命性的檢驗方式,我認為癌症篩檢5年內就會成為年度體檢的一個項目,跟年度體檢的抽血檢驗一樣簡單。」
他已針對數千名罹患肺癌、乳癌、結腸癌、胰腺癌或卵巢癌的患者進行液態切片研究,認為這種方式可早期發現癌症。
目前,在美國及其他國家的大醫院或癌症中心都有使用液態切片,包括MD Anderson Cancer Center,加州大學,Dana Farber Cancer Institute,以及史丹福大學醫學院。
台灣各大教學醫院,如耕莘醫院、中心診所、馬偕醫院以及即將開幕的精準醫學中心,也已提供新的液態切片檢測技術,但健保沒有給付。據了解,做一次液態切片檢測需約16萬新台幣。
精準醫療的最前沿領域之一
儘管液態切片目前仍相當昂貴,美國血液檢測癌症公司– Guardant Health每次的檢驗也要價5,400美元,即使一些健保方案提供局部補助,對許多患者來說仍難以負擔。
不過,腫瘤液態活檢仍成為目前最具發展潛力的腫瘤無創診斷和即時療效監測手段,有別於傳統的臨床診斷,液態檢驗平均約需12天,傳統切片檢驗則約需一個月,該方法具有簡便、安全、無創、即時等特點。
作為體外診斷的一個分支,廣義而言,腫瘤液態活檢主要是指,以外周血液為主的體液標本中細胞及核酸的檢測。通常包括了循環腫瘤細胞 (Circulating Tumor Cells, CTC)和循環腫瘤DNA (Circulating tumour DNA, ctDNA)或者外泌體(exosomes),是目前精準醫療的最前沿領域之一。
CTC是由實體瘤或轉移所釋放,進入外周血循環的腫瘤細胞,側重於細胞病理,適用於治療後的病情監測,判斷預後等;而 ctDNA 是腫瘤細胞釋放到血液循環系統中的游離DNA,側重基因層面,獲取突變資訊,適用於早期篩查、個體化用藥指導、耐藥性監測等;外泌體所含資訊豐富,包括蛋白質、RNA 等,不僅能用於臨床診斷,還可能可用於疾病的治療,未來發展空間廣闊。
CTC檢測與ctDNA/cfDNA檢測,具有各自的特點(見表一)。從用途上看,CTC主要用於前端,包括疑似癌症時的輔助診斷、早期癌症的復發監測,以及晚期癌症的化療;ctDNA主要用於晚期癌症的靶向治療(伴隨診斷),若應用在早期,將有更大的市場空間。
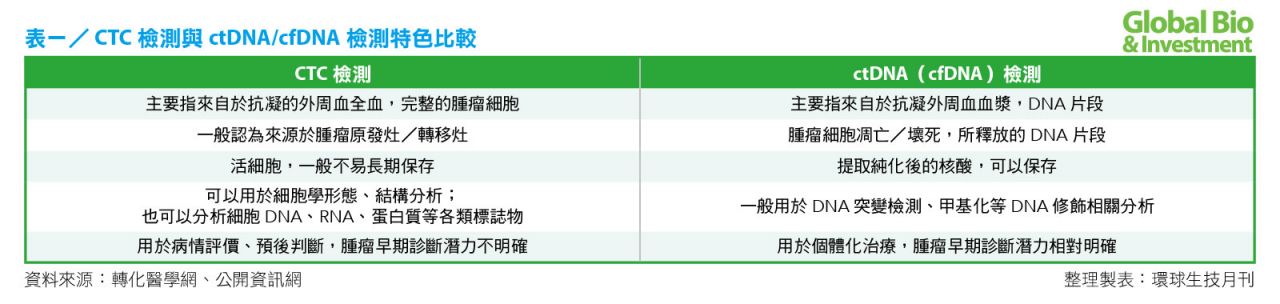
若從技術上分析,CTC側重於細胞病理,ctDNA則採用獲取分子層面突變信息的技術手段。就目前可實現的技術而言,突破單純的數量檢測,CTC實現輔助診斷、ctDNA實現標靶用藥指導,是大規模商業化的主要方向。
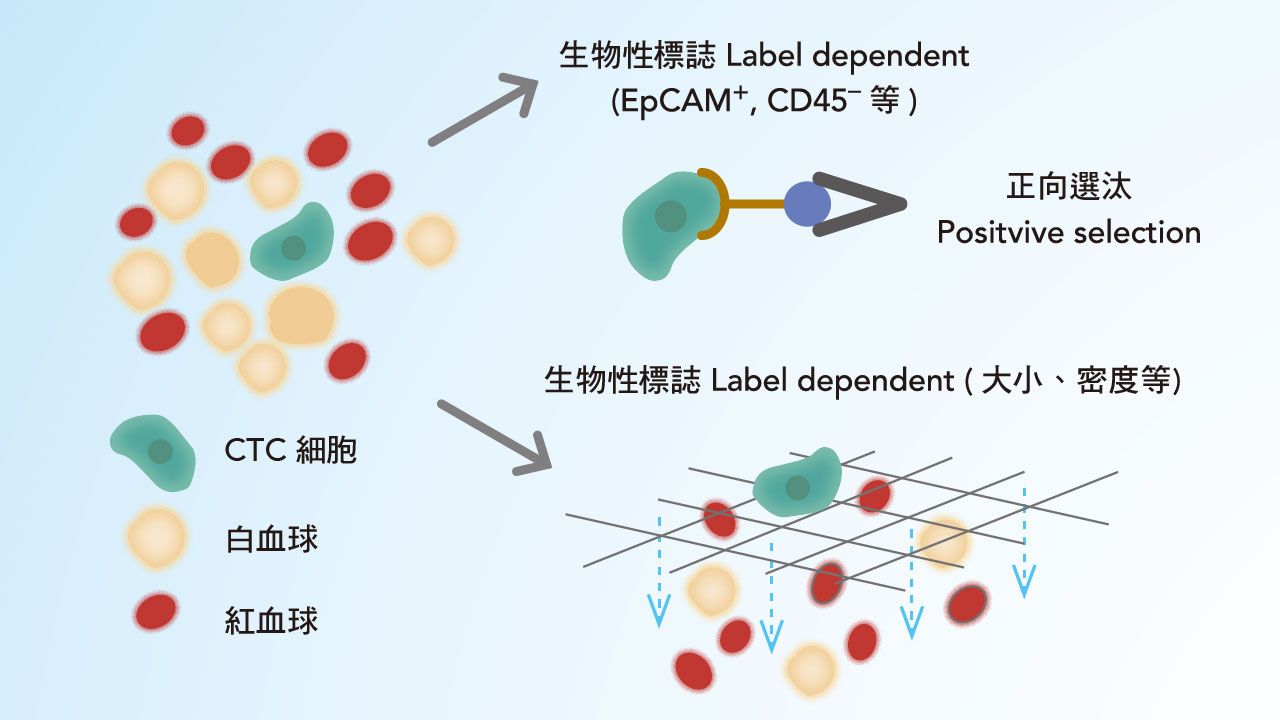
CTC篩檢可透過特定的濾膜,或對CTC本身之抗原抗體的識別等方式篩查。
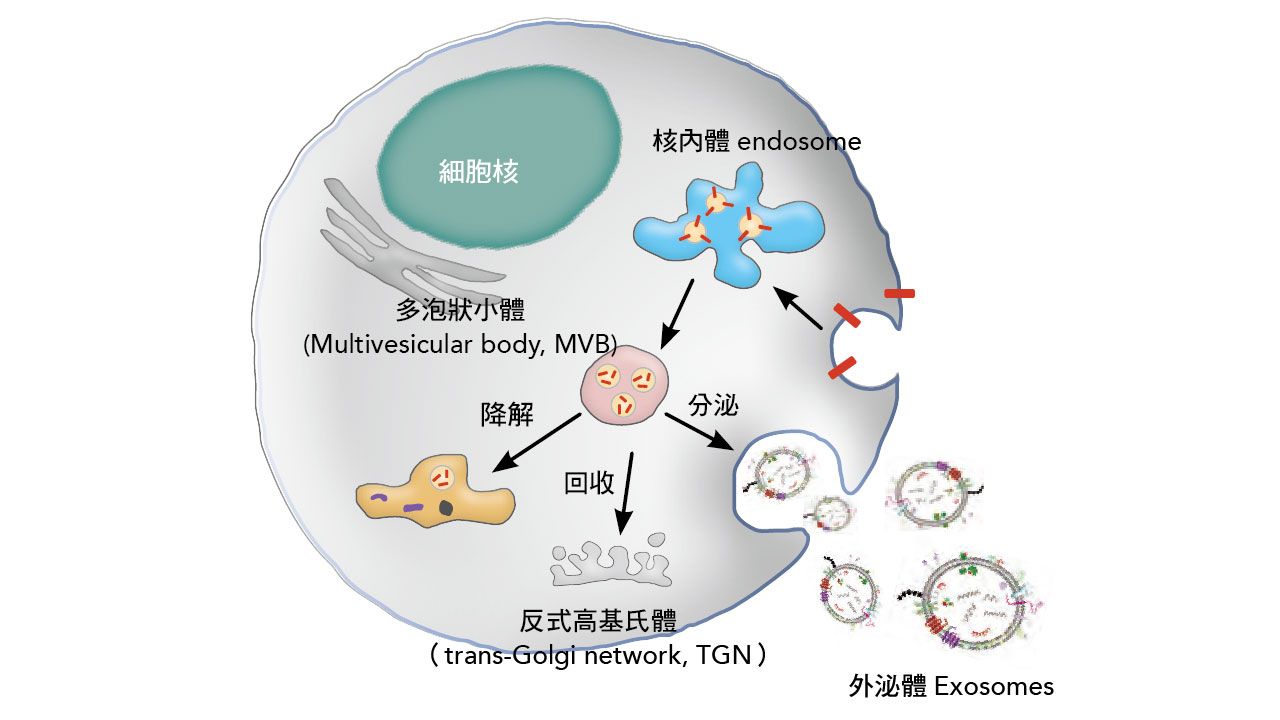
外泌體攜帶的信息多元,其中的蛋白質和核酸片段,均可用於癌症檢測。
結合ICT優勢 台灣大有可為
幾年前,液態切片除研究外鮮少使用,但目前全球臨床已進行數萬次檢驗,液態切片在許多癌症已是組織切片的替代方案。
此種液態切片檢驗方式,成為國內外醫師、研究人員、創投與企業重資投入的癌症治療檢測新「聖杯」。
一些台灣廠商已相繼投入開發並提供檢驗服務。如2016年底發表革命性大腸直腸癌ctDNA檢測的合度精密生技,這項技轉自中央研究院的技術,獲得美國《華爾街日報》以「能在數10億顆血球細胞中找到癌細胞的技術,來自台灣。」加以報導。
該公司去年7月宣布,獲900萬美元的增資,總投資額達4.5億元新台幣,增資來源包含美國矽谷知名創投公司Artiman與有台灣科技教父美稱的宏碁集團創辦人施振榮等人。
今年1月5日登錄興櫃的慧智基因,團隊源自台大醫院基因醫學部分子遺傳實驗室,慧智基因已可利用液態切片及次世代定序(NGS)技術偵測腫瘤風險及治療癒後情況,並與Roche合作引進市面上目前唯一經美國FDA核准的液態切片肺癌用藥基因檢測。
二代CTC及ctDNA技術在海外也蓬勃發展,然而目前二代液體活檢技術有待成熟且沒有統一的標準。台灣從科技部補助的研發計畫中,也可見有研究單位已進行研發次世代的CTCs之液態病理切片晶片,導入半導體製程以及微流體技術於生物晶片,希望開發出更具靈敏度的晶片檢測。
台灣有非常好的基礎研究和完善的醫療系統,目前針對外泌體,各大醫院有不少癌症偵測的研究。臺大醫學院副院長李財坤在一場論壇就公開表示,他認為外泌體的應用層面廣泛,舉凡產前檢查、慢性病風險預測/追蹤/治療等,都是可發展的方向,若能結合台灣在IC和電子產業的優勢,台灣在外泌體的領域大有發展。
全球市場 230 億美元
液態切片市場潛力巨大。國際醫藥巨頭和風險投資者早已瞄準了這一炙手可熱的領域,如強生旗下子公司Veridex收購Immunicon的CTC業務、Roche收購德國腫瘤轉化和基因組學公司SignatureDiagnostics。
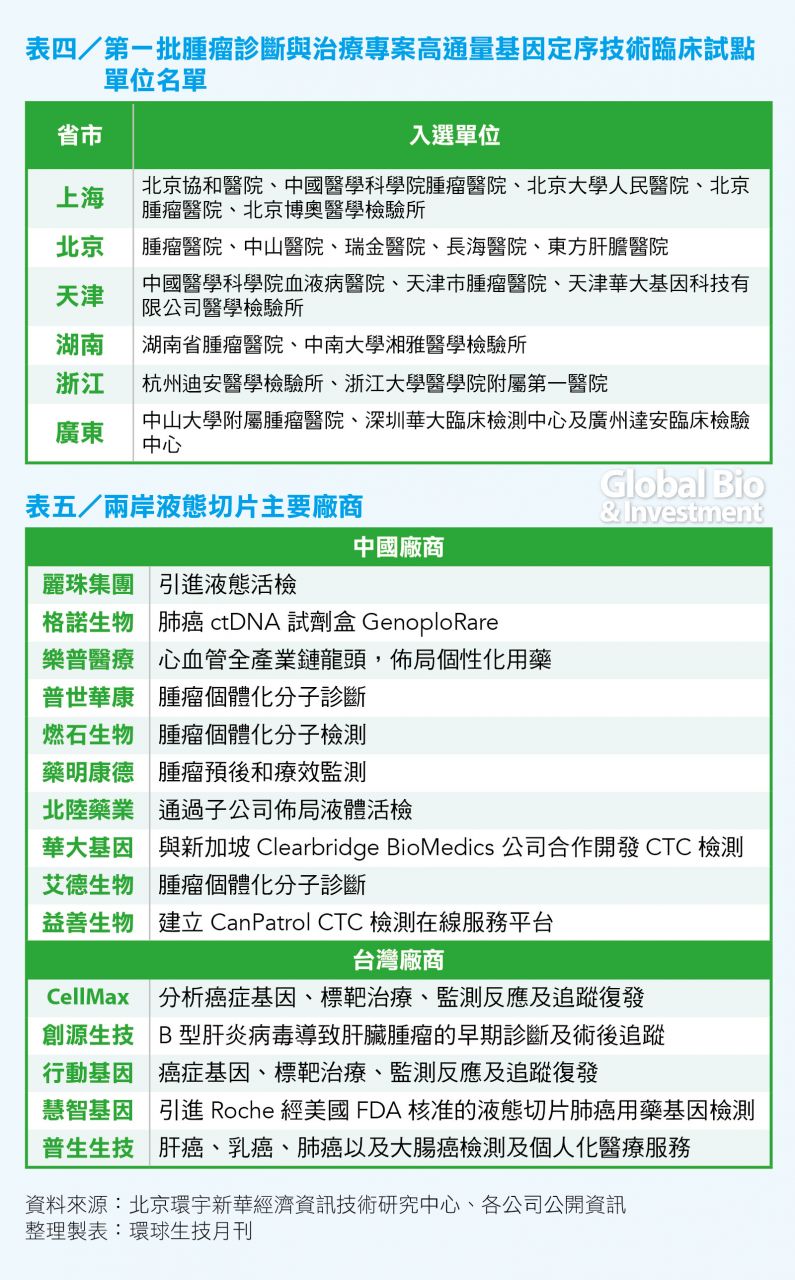
中國液體活檢市場也悄然成型,據中國21世紀經濟報不完全統計,中國目前有47家公司在從事腫瘤液體活檢,其中,26家公司選擇ctDNA,9家公司選擇CTC,代表性企業包括華大基因、藥明康德、燃石生物、普世華康等。(參見表五)
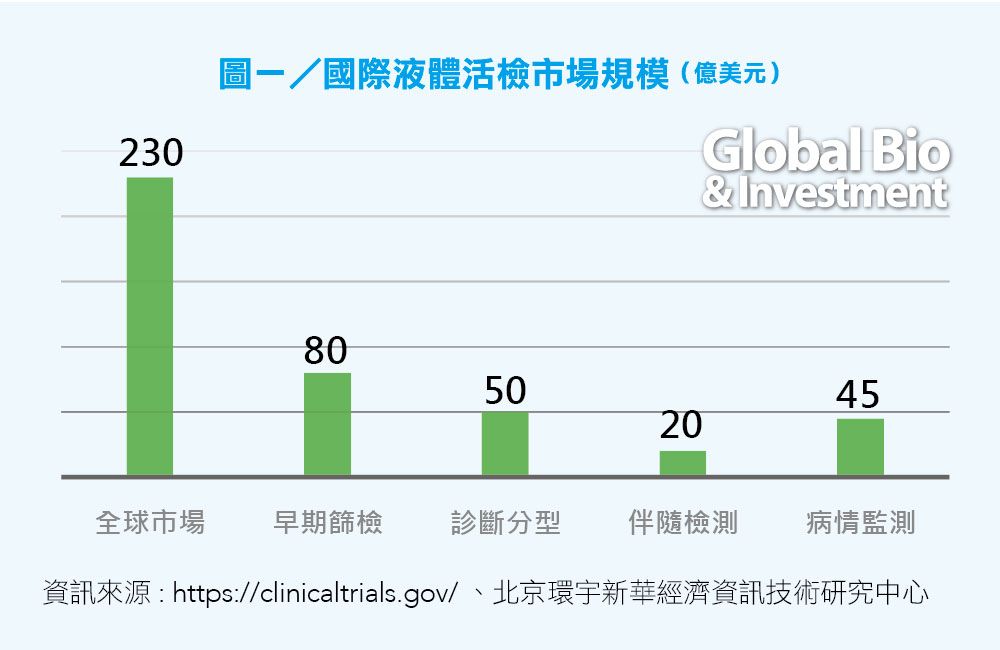
JP摩根則將液體活檢分為早期篩查、診斷分型、藥物伴隨檢測、患者病情檢測 4個細分領域,預計全球市場潛力為 230 億美元。(見圖一)
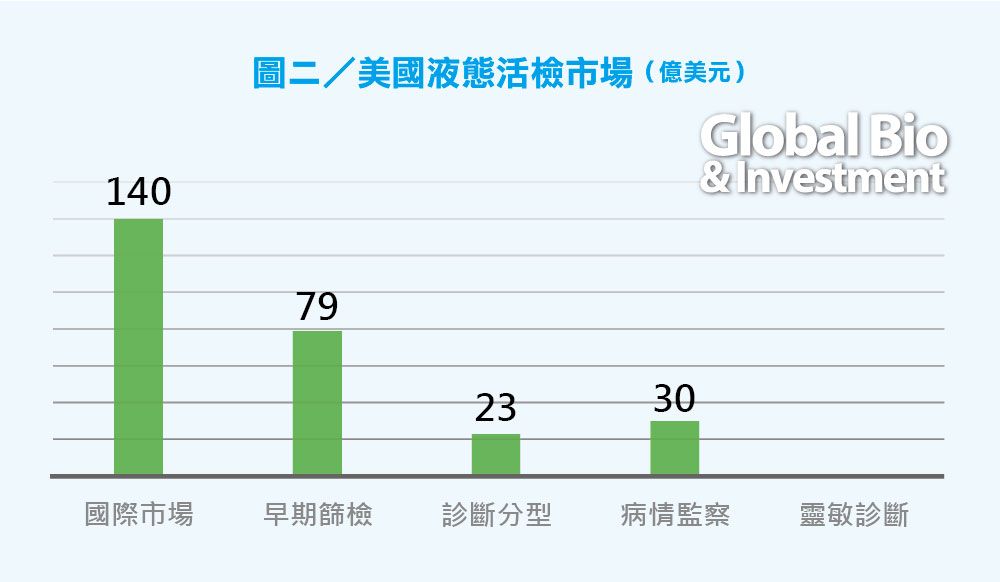
高盛也將液體活檢應用分為4個領域,預計其在美國的市場潛力可達到 140 億美元,預測該市場需要 5〜15 年才能完全成熟。(見圖二)
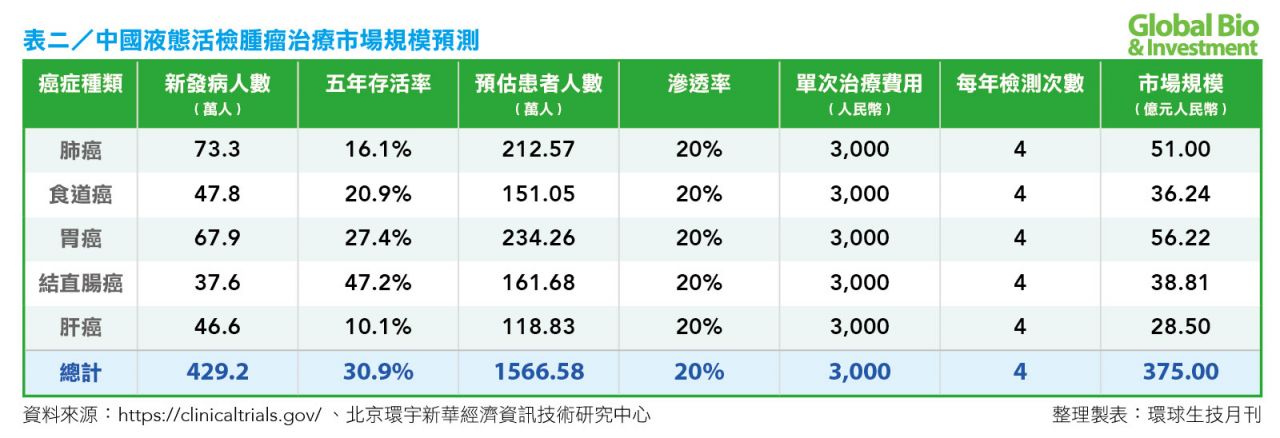
香港中文大學醫學院分子生物學臨床應用權威專家盧煜明,則更樂觀預估,癌症液體活檢未來市場將高達375 億元。(見表二)
無論如何,根據不同機構公開資料的預測,都可以看到,未來液態活檢將有百億美元的市場空間,其中,又以腫瘤的早期篩查所占比率最大。
中國未來5年 早期篩檢胃癌空間最大
中國液態切片的市場潛力驚人。若根據盧煜明所引用數據及分析來看,2015 年中國新發癌症數量約為 429.2 萬人,好發的5種癌症中,肺癌 73.3 萬人,食道癌 47.8 萬人,胃癌 67.9 萬人,結直腸癌 37.6 萬人,肝癌 46.6 萬人。
以癌症每年的存活率1/5、治療的滲透率為 20%計算,每次治療的價格為 3,000 元,每年檢查 4 次。(市場規模=癌症患者人數x滲透率x每次治療的價格x檢測頻率)。未來癌症的病情監測、診斷分型、個人化用藥等患癌後的治療市場約達375 億元。其中,胃癌5年存活率大,未來癌症治療市場可能也最大。
不過,中國國信證券推測,由於中國地域廣闊,區域間的醫療水平差異很大,加上醫保經費緊張,短期內仍不太可能覆蓋這種新的檢測技術,保守預計該技術在未來5〜10年的市場滲透率為50%。中國液體活檢的市場潛力約為200億元。
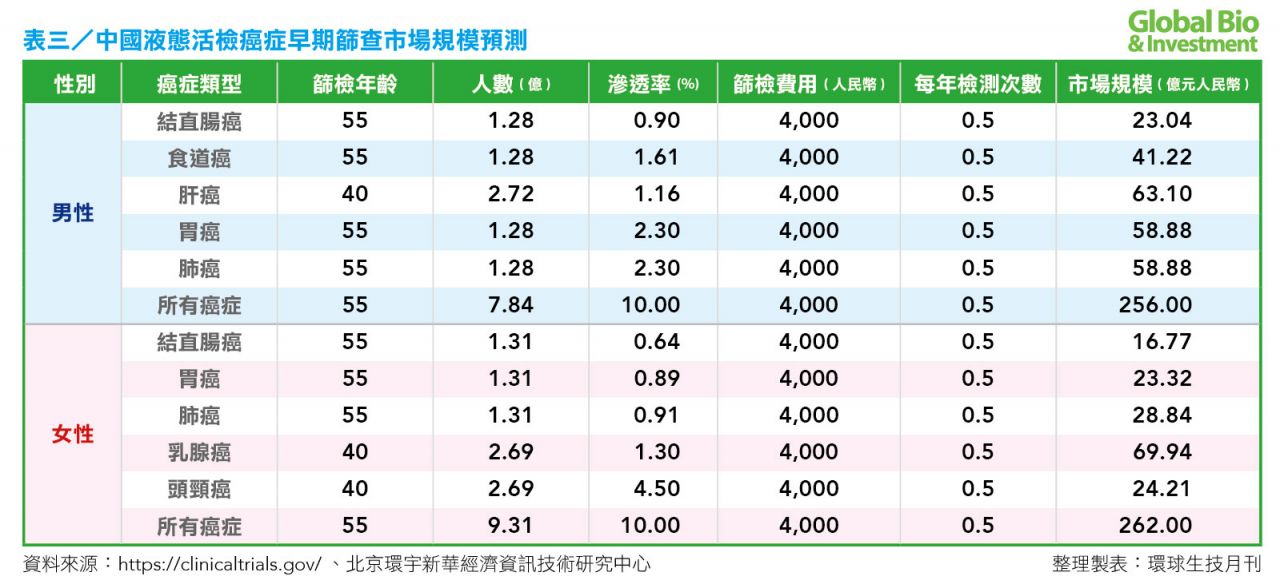
又對於男性而言,胃癌和肝癌都是好發的癌症,在 60〜75 歲的區間發病率最高,肝癌發病率和死亡率都很高,發病高峰在 45〜59 歲的區間,其他癌症發病高峰也在 60〜75 歲的區間。對於女性而言,乳腺癌和頭頸癌的發病比較早,發病高峰在 45〜59 歲;其他癌症的發病高峰均在 60〜74 歲。
預計,中國未來癌症篩查的早期篩查市場規模約在 518 億元(見表三),其中男性中肝癌,胃癌和肺癌未來市場空間比較大。對於女性癌症而言,乳腺癌由於發病年齡早,發病率高,是未來癌症早期篩查市場空間最大的一種癌症。
此外,未來ctDNA 檢測發展,有望一次篩查多種癌症,亦將有助於液態活檢的市場推廣。
目前,由強生公司所開發,全球第一個經過美國FDA和中國CFDA批准,用於惡性腫瘤疾病管理的檢測CTC產品CELLSEARCH®已於2013年正式在中國銷售。
應用CELLSEARCH®系統,只需7.5ml的血液樣本,即可從400多億血球細胞中檢測到低至單個CTC。檢測一次收費標準約4,000〜5,000元人民幣,尚未進入醫保名錄。亦由於不是一次性檢測,為動態檢測,需要多次檢測比對結果,一位患者至少要檢測3〜4次,4次下來需2萬多元,一般病人恐怕無法承擔。
由於價格昂貴,加上CELLSEARCH®系統仍存在技術上缺陷,抗體捕獲方式局限性仍大,且無法實現活細胞捕獲以進行後續基因檢測以及用藥指導。據瞭解,CELLSEARCH®系統引進中國醫院的實際檢測量不盡如人意,北京的6、7家醫院平均年檢測量不到200件。
因此,中國業界已一致宣稱CELLSEARCH®自2016年6月開始停止銷售,2015年年底生產即已告停。
CTC未來爆發更早 乳腺癌、非小細胞肺癌臨床最多
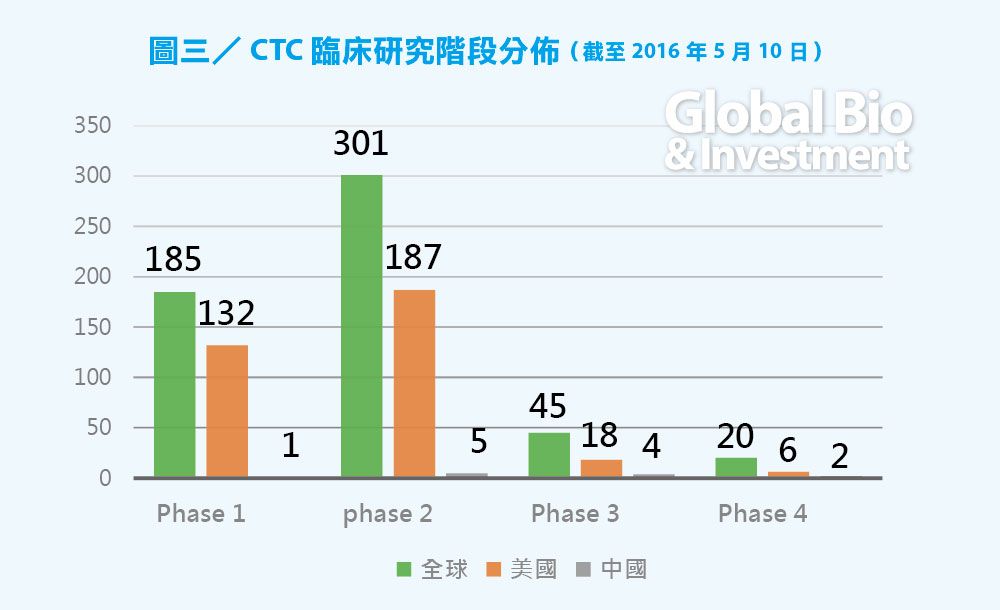
從全球液態活檢的臨床進展來看,CTC 目前約有530例臨床實驗(不計算失敗的和註冊但未開始的),ctDNA 約有83個臨床實驗,外泌體相關的臨床實驗研究約9 個。
比較而言,CTC 研究更多,未來爆發更早。目前全球已有 20 個 CTC 的四期臨床實驗,預計 2〜3 年內會有更多 CTC 檢測產品面世。
ctDNA 研究相對較少,主要的臨床研究還在一期和二期,預計 3〜5 年後才會逐漸有產品上市。外泌體由於研究起步晚,臨床研究非常少,沒有四期臨床實驗。(見圖三、四、五)
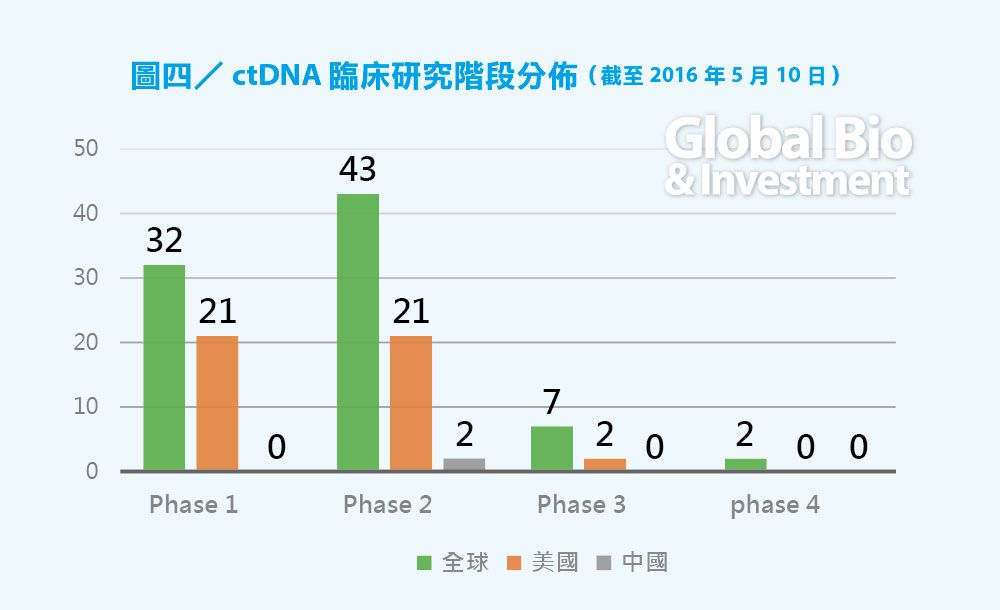
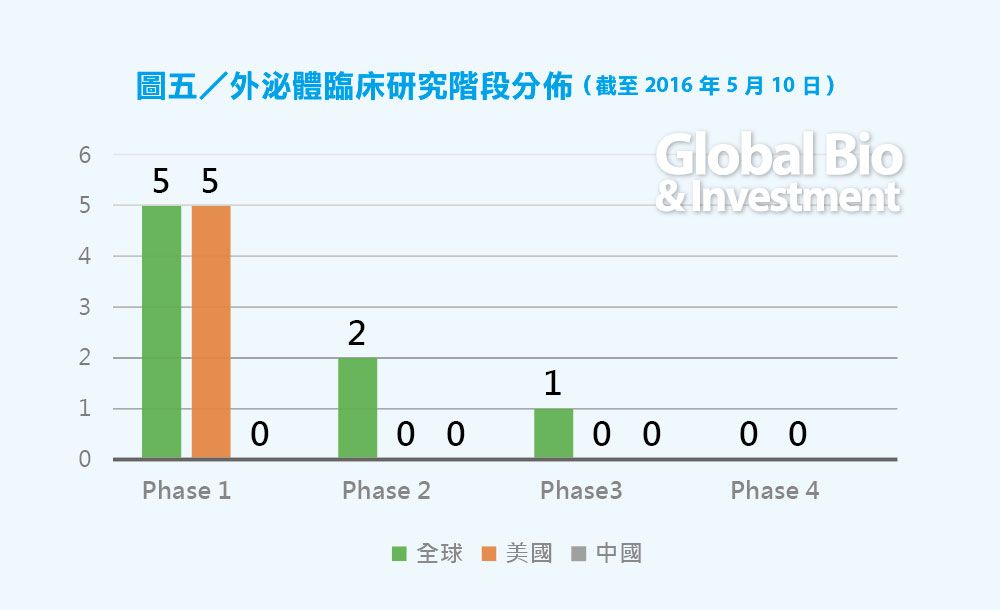
從臨床研究的角度看,研發進度上 CTC > ctDNA > Exosome,北美>西歐>東亞,未來北美和歐洲依然是液態活檢發展最活躍的地區。
近年來,中國對精準醫療的關注及扶持逐漸上升,癌症液態活檢身處其中,發展極為迅速。目前,有大量液態活檢的LDTs (實驗室自建的臨床檢驗專案)正在進行,隨著未來臨床結果的公佈,將有更多標準形成。
預計在未來 2〜3 年將是CTC檢測技術的爆發期,大量處於臨床三期和四期的產品將進入市場。ctDNA 目前還不成熟,進入市場還需要時間,預計 3〜5 年後才會是 ctDNA 的爆發期。
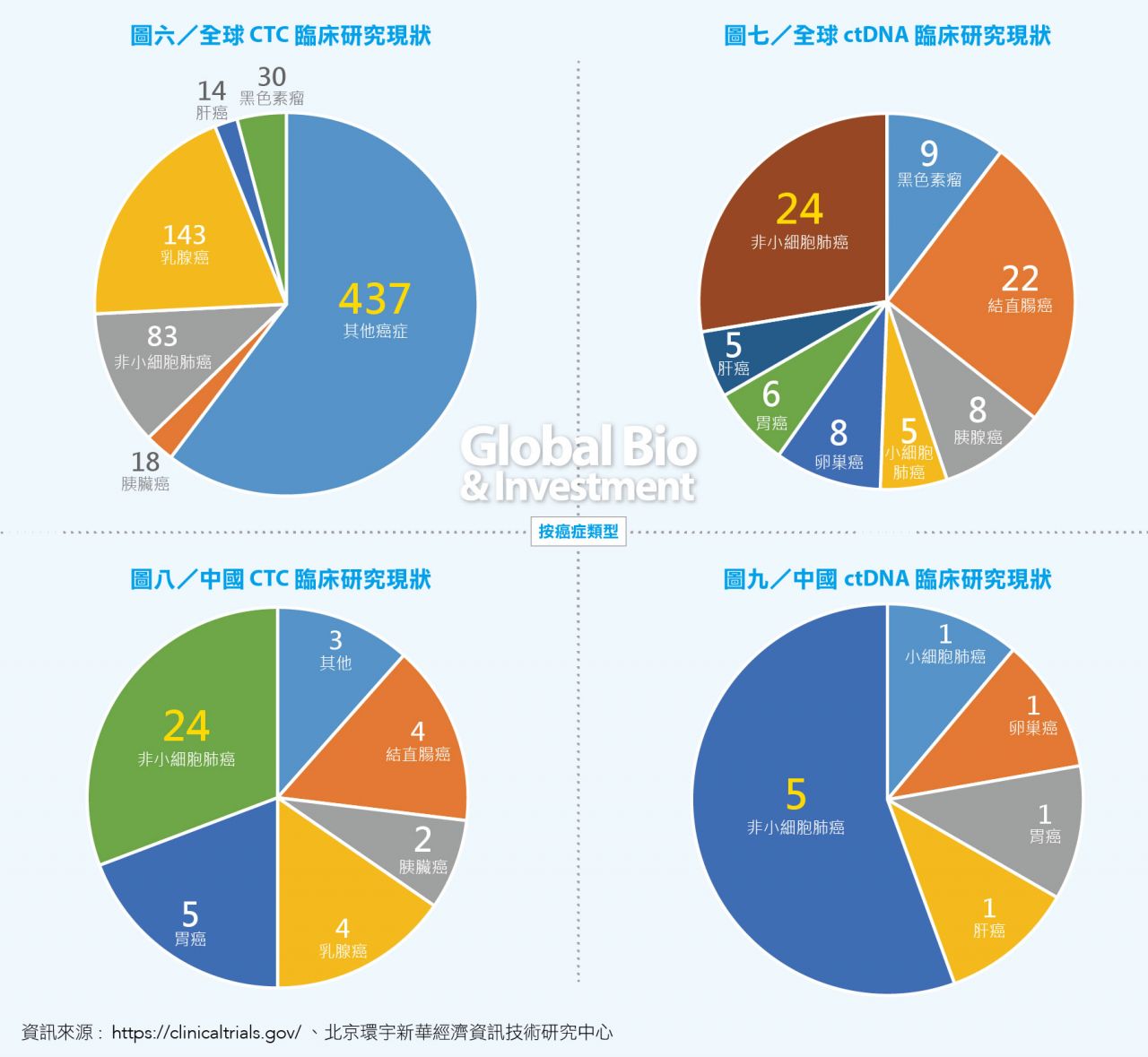
從臨床研究的情況來看,全球 CTC 臨床研究以乳腺癌最多,ctDNA 臨床研究以非小細胞肺癌最多。預計未來全球液態活檢最快會在非小細胞肺癌和乳腺癌上獲得突破,然後向其他癌症類型發展。(見圖六、七)
中國的臨床研究中非小細胞肺癌佔有很重要的比重,一方面,中國肺癌患者比較多;另一方面,非小細胞肺癌的研究比較清楚,幾個關鍵的突變在精準醫療上已有很好的研究基礎,預計液態活檢在中國內最先有所突破的是非小細胞肺癌。(見圖八、九)
美國CLIA 認證
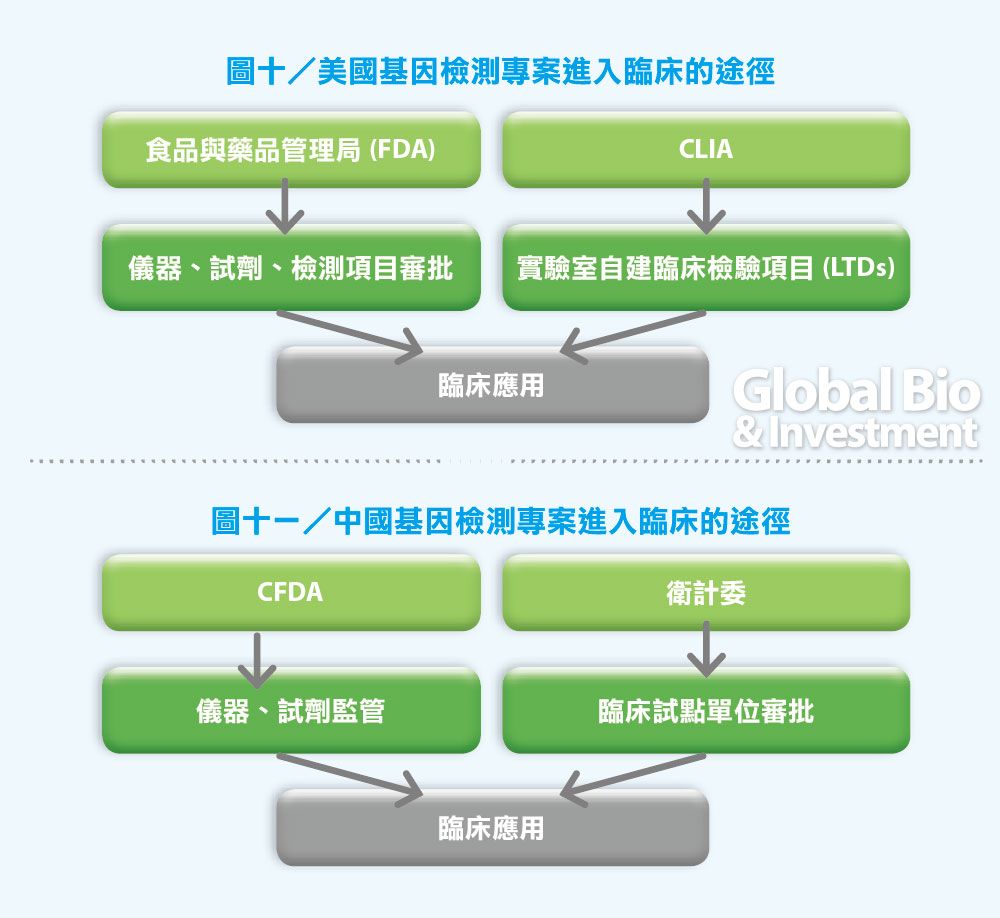
美國基因定序產業是由醫療保險和醫療補助服務中心(CMS)、食品及藥品管理局(FDA)和聯邦貿易委員會(FTC)共同監管。
CMS主要通過《臨床實驗室改進法案修正案》(CLIA)監管消費級和科研級應用,FDA負責臨床級產品的審查,FTC則負責監管其中錯誤和有誤導性的產品宣傳。
美國大部分液態活檢公司都是走CLIA認證,而非FDA認證。美國有近80%的實驗室通過了CLIA 認證,也意味著通過CLIA的實驗室能夠根據市場的現實需求,快速地開發實驗室自建專案,並通過在臨床上的應用給予可靠的臨床指導。
CLIA認證解決了基礎研究和臨床應用之間低效率轉化甚至脫節的問題,對轉化醫學和研究成果轉化有非常重要的意義。(見圖十)
中國也借鑒了這種方式來規範中國國內基因檢測公司的競爭。根據 CFDA 在 2014 年 1 月公佈的《食品藥品監管總局辦公廳關於基因分析儀等三個產品分類界定的通知》, 基因定序診斷產品(包括基於定序儀、相關診斷試劑和軟體),符合醫療器械的定義,應作為醫療器械管理,其中定序反應通用試劑盒(定序法)劃為 I 類醫療器械管理產品,基因定序儀作為 III 類醫療器械管理。(見圖十一)
液態活檢的業務也必須通過試點單位及試點醫院,才能進行臨床實驗的進行。2015年3月27日,中國國家衛生計生委醫政醫管局也發佈了第一批腫瘤診斷與治療項目高通量基因定序技術臨床試點單位名單。北京市、上海市、湖南省、浙江省、廣東省有多家醫療機構和協力廠商檢驗實驗室入選。(見表四)
整體而言,液態活檢發展尚處早期,技術仍有待開發,但在官方鼓勵精準醫療發展下,液態活檢將乘風而起,前景極為廣闊。
中國市場雖增長迅速,但液態活檢滲透率會是一個長期緩慢提升的過程,一二線城市發展較快。此外,液態活檢未來單次檢測費用也將明顯降低。
>>本文刊登於《環球生技月刊》Vol. 41









