領導該研究的UTSW Lyda Hill生物資訊系主任暨細胞生物學教授Gaudenz Danuser特別指出,一句古老的格言是「形式追隨功能」(form follows function),意思是物體的形式、形狀,應該要根基於其功能或目的。但這篇研究顯示,透過改變形式(抑制突起囊泡的形成),竟可以改變功能(改變控制細胞功能的化學反應),顛覆了「形式追隨功能」的概念!
共同領導該研究的Andrew D. Weems博士解釋,健康細胞從較大的組織中分離出來後,幾乎會經由失巢凋亡(anoikis)程序而死亡,除非它們能夠在幾小時內重新附著組織。
然而,惡性腫瘤細胞從腫瘤組織中分離,還是能夠永遠活下去,這使得該細胞能夠存活並遷移到身體其他部位,形成轉移性腫瘤。惡性腫瘤細胞在與組織分離時,會無限期地形成「突起囊泡」,而健康細胞在從其原始組織分離後只能形成「突起囊泡」約一個小時。
Danuser實驗室以前的研究已發現,「突起囊泡」收集的蛋白質,可以促進細胞在壓力條件下存活。但這些蛋白質是否幫助癌細胞免於失巢凋亡,以及這些蛋白質是如何被包含在「突起囊泡」中仍然未知。
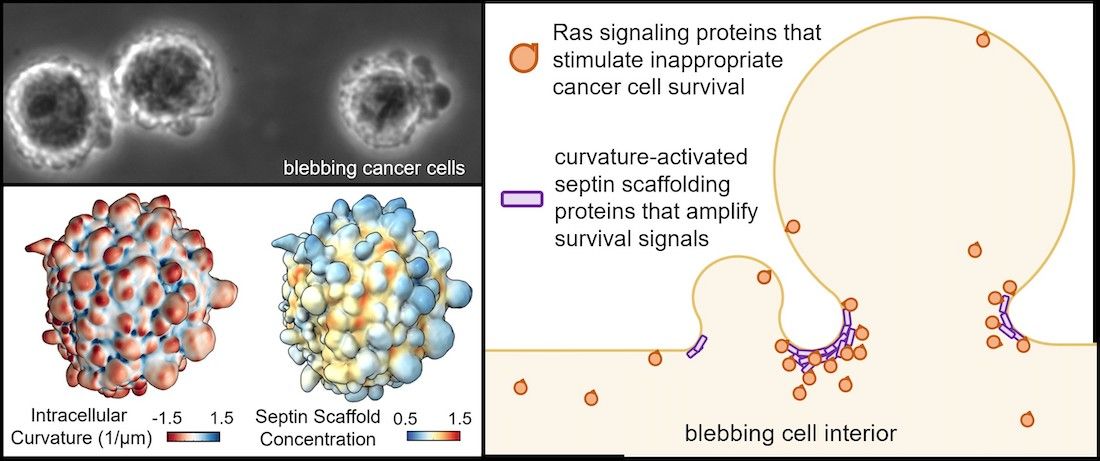
這些研究顯示,「突起囊泡」吸引了稱為septins的蛋白質家族,septins會形成分子支架,為蛋白質的相互作用提供框架。Weems表示,這裡的septin支架包含Ras蛋白質,該蛋白質會調節細胞生存,且在大約五分之一的癌症中,Ras蛋白都有突變。
當研究人員對黑色素瘤細胞施予抑制septins的化合物福芬素(forchlorfenuron, FCF)時,septins就無法再支撐Ras蛋白,導致細胞無法維持存活所需的化學反應。
因此,當黑色素瘤細胞與其他細胞分離時,它們就會死亡,變得與健康細胞的命運相同。而如果在健康細胞引入突變,使其形成「突起囊泡」的時間比平常更長,這些健康細胞會變得像癌細胞一樣能對抗失巢凋亡,即使它們不帶有致癌的Ras突變。
Danuser表示,這項研究揭示,所謂的致癌突變並不足以驅動癌症反應,但致癌突變可能需依賴特定的細胞結構,才能實現癌細胞的擴散。
Danuser說:「這提供了一種全新的觀點來看待癌症的發展。」
由於Ras具有特殊的分子結構,其被認為是不可成藥的靶點,科學家嘗試抑制Ras的活性幾十年,但都沒有成功。
如果改為靶向septins,研究人員將有可能實現相同目標,也就是消除癌細胞抵抗失巢凋亡的能力,讓癌症更容易受到化療、放療或免疫療法等其他治療的影響。
Weems表示,FCF在美國被用作農業化學品已有近20年的時間,環境保護署的數據顯示它對人類的毒性很低。這類抑制septin的化合物,可能成為新的候選抗癌療法。
參考資料:https://www.utsouthwestern.edu/newsroom/articles/year-2023/march-cell-membrane-blebs.html
論文:https://www.nature.com/articles/s41586-023-05758-6
(編譯/劉馨香)









