近(17)日,美國華盛頓大學和斯克里普斯研究所在《Cell》發表研究,以結構生物學的強大新工具——冷凍電子斷層掃描(Cryo-ET),解析人類免疫缺乏病毒(愛滋病毒)(HIV)的細微結構,並瞭解病毒表面的Env蛋白與內部蛋白結構之關係,推翻先前關於病毒如何組裝的模型,成果將有助於愛滋疫苗的設計和開發。
HIV套膜(envelope)上的「棘突」Env蛋白,是介導病毒進入宿主細胞之處,為中和抗體阻斷感染的作用目標。
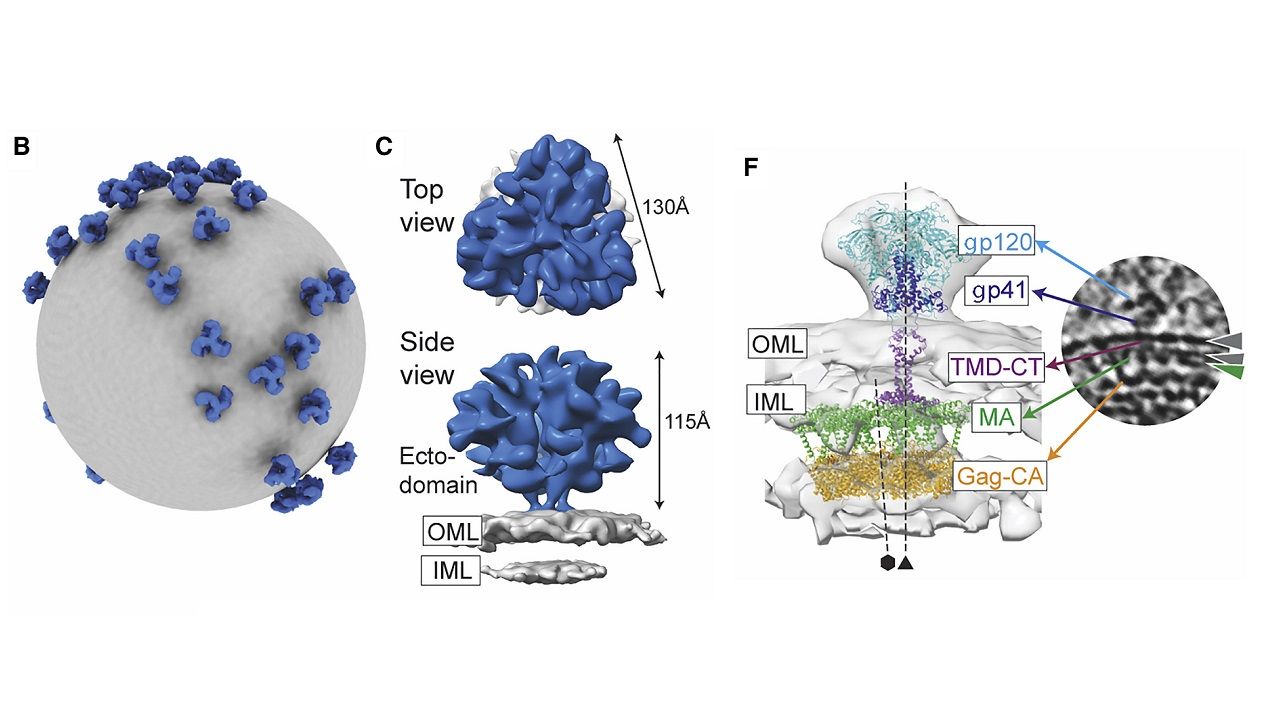
針對Env蛋白的研究,一般來說科學家得從病毒中分離出蛋白質顆粒,或是以基因工程表現該蛋白才能研究結構,但在此研究中,團隊利用Cryo-ET直接解析出整顆病毒在顯微鏡立體視野下的Env蛋白結構和位置。
研究的另一項關鍵發現,是對「糖盾(glycan shields)」有全新認識,糖盾指的是蛋白質上的糖,其使病毒能躲避免疫系統。
領導研究的華盛頓大學藥學院藥物化學副教授Kelly Lee說:「我們正在研究整個HIV病毒顆粒,以及病毒表面上的Env蛋白與病毒的其他部分有什麼關聯性。透過觀察完整的病毒結構,我們可以觀察到Env蛋白是如何展示出不同面貌,以及它們如何被免疫系統辨識或隱藏。」
病毒的完整3D圖像,也使科學家們對病毒表面上的Env蛋白,相對於病毒內部蛋白質結構(稱為Gag晶格)的定位,獲得了新的見解。
Lee說:「這一發現推翻了之前關於病毒各部分如何組裝的模型,並有助於將我們的注意力,集中在這兩種蛋白質的對接作用可能在哪裡發生。這種交互作用需要更詳細地研究,但這項新發現,至少為我們提供了正確的病毒組裝架構模型。」
研究也發現過去未觀察到的事實:Env蛋白連接至套膜的「柄部 (stalk)」,是靈活的且可傾斜,這對於免疫系統中保護細胞免受感染的中和抗體來說,既是機會也是挑戰。
論文共同通訊作者、斯克里普斯研究所免疫學與微生物學副教授Michael Zwick表示,HIV套膜使愛滋疫苗開發非常困難,因為套膜上的棘突蛋白實在非常少,而且以糖分子進行偽裝,逃避了我們的免疫系統。所有這些特徵,都增加了HIV棘突蛋白呈現給免疫系統時的動態變異性。
Zwick表示,當我們越來越清楚我們的目標(Env蛋白),將能激發創新,並改進疫苗的設計和開發。
參考資料:https://www.futurity.org/hiv-aids-vaccines-viruses-2700672/
論文:https://www.cell.com/cell/fulltext/S0092-8674(22)00071-X
(編譯/劉馨香)


- Global Bio and Investment Monthly
- 讀者服務電話:+886 2 2726 1065時間:週一 ~ 週五 09:00 ~ 18:00
- 服務信箱:[email protected]
- 地址:110臺北市信義區信義路六段29號2樓之一, Taiwan
- Copyright© 2024 環球生技多媒體股份有限公司. All rights reserved.本文內容受著作權法保護,如有引用請註明出處。授權申請。隱私宣告Privacy。會員條款User Terms。
為了提供您最佳的服務,本網站會在您的電腦中放置並取用我們的 Cookie,若您不願接受 Cookie 的寫入,您可在您使用的瀏覽器功能項中
設定隱私權等級為高,即可拒絕 Cookie 的寫入,但可能會導至網站某些功能無法正常執行 。