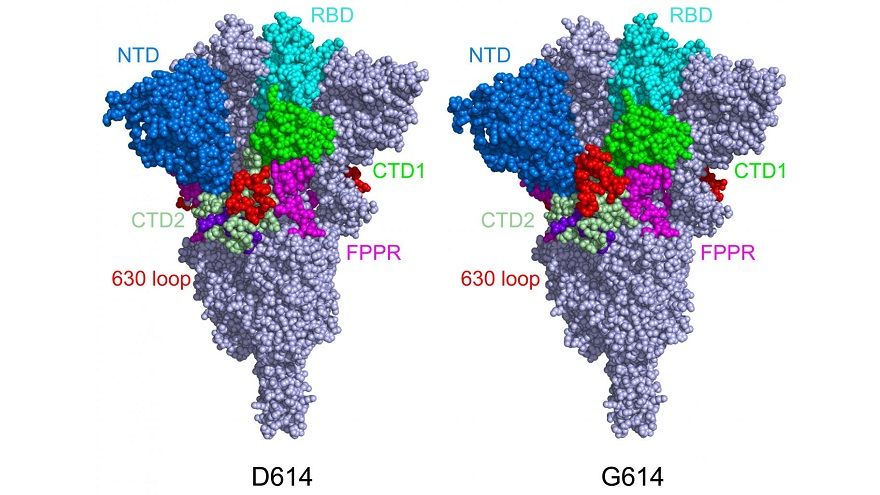
美國時間16日,波士頓兒童醫院以冷凍電子顯微鏡(cryo-EM)研究發現,英國、南非、巴西變種病毒共同的突變「D614G」,能使病毒的棘蛋白(spike protein)更堅固,不會過早脫落,這解釋了為什麼這些變種病毒能快速傳播。該研究發表於《Science》。
原始新冠病毒感染人類時,棘蛋白會與ACE2受體結合,然後急劇地改變形狀、自我摺疊,使病毒的外套膜與細胞膜融合,接著進入細胞。然而,該研究團隊在去年7月曾發現,棘蛋白有時會太早改變形狀,和細胞結合前就已經解體。這使得病毒感染力較差,也使得我們的免疫系統較難以辨認。
研究領導人波士頓兒童醫院教授Bing Chen說:「因為原始病毒的棘蛋白會分離,較難以引起人體強烈的中和抗體反應。」
研究團隊由突變棘蛋白的影像發現,D614G突變阻止了棘蛋白過早改變形狀,因而更穩定。有趣的是,D614G突變使棘蛋白與ACE2受體的結合較弱,但棘蛋白不會過早脫落,讓這些病毒有更多功能性的棘蛋白可與人類細胞的ACE2受體結合,整體來說,病毒感染力還是更強。
Bing Chen解釋,由於原本棘蛋白的不穩定性,可能只有50%的棘蛋白能起作用,但突變株可能有90%的棘蛋白可作用,即使結合力較弱,但人們被感染的機率仍增加。
Bing Chen建議針對此突變重新設計疫苗,尤其是以棘蛋白為設計基礎的疫苗,包括莫德納(Moderna)、輝瑞(Pfizer)、嬌生(J&J)的新冠疫苗。疫苗若有愈穩定的棘蛋白,將愈能夠引起保護性的中和抗體。
資料來源:https://bioengineer.org/a-sturdier-spike-protein-explains-the-faster-spread-of-coronavirus-variants/
原始論文:https://science.sciencemag.org/content/early/2021/03/16/science.abf2303


- 讀者服務電話:(02)2726-1065時間:週一 ~ 週五 9:00 ~ 18:00
- 服務信箱:[email protected]
- 地址:110臺北市信義區信義路六段29號2樓之一, Taiwan
- Copyright© 2024 環球生技多媒體股份有限公司. All rights reserved.本文內容受著作權法保護,如有引用請註明出處。授權申請。隱私宣告Privacy。會員條款User Terms。
為了提供您最佳的服務,本網站會在您的電腦中放置並取用我們的 Cookie,若您不願接受 Cookie 的寫入,您可在您使用的瀏覽器功能項中
設定隱私權等級為高,即可拒絕 Cookie 的寫入,但可能會導至網站某些功能無法正常執行 。