中國一連串藥改制度讓中國學名藥產業正式面臨全面洗牌,但另一方面也為這個全球第二大學名藥市場騰出空間。了解化學藥品註冊分類調整的新辦法、掌握一致性評價、運用相關獎勵政策等法規,將是具備能力與條件之企業的致勝關鍵。
文/劉鈺鋒、王柏豪
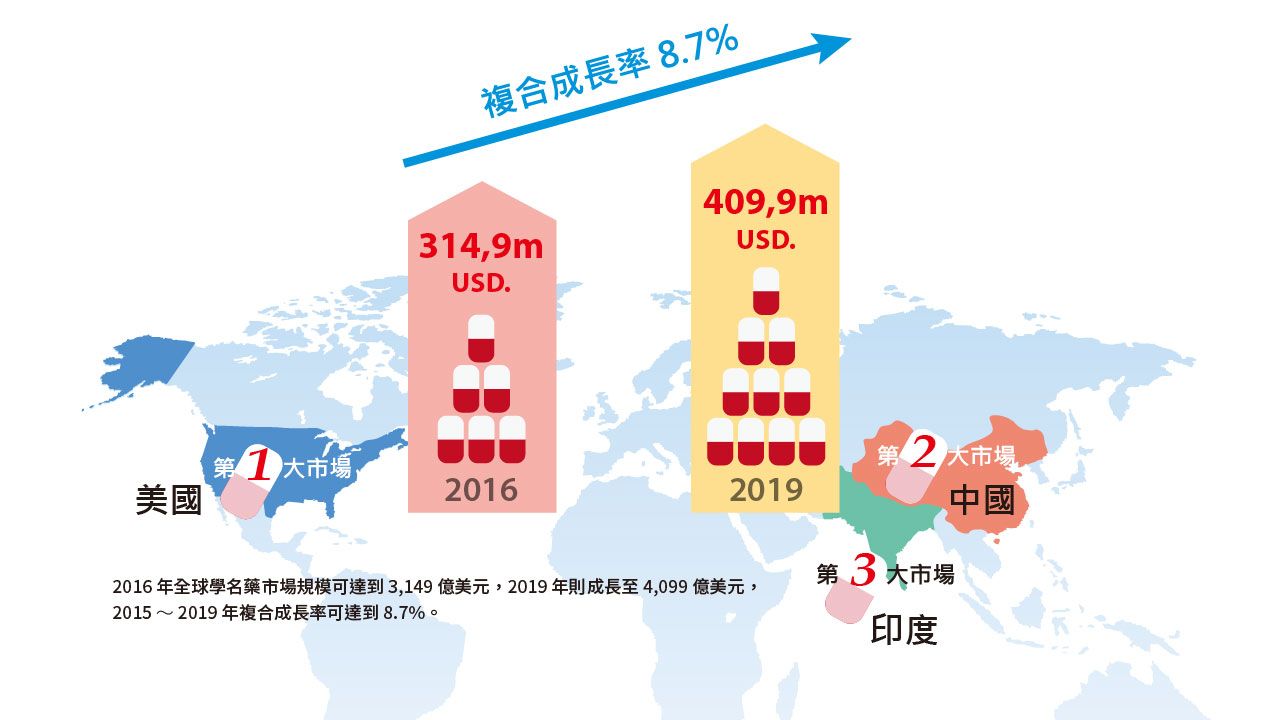
根據TrendForce預估,2016年全球學名藥市場規模可達到3,149億美元,2019年則成長至4,099億美元,2015〜2019年複合成長率可達到8.7%。
其中美國仍是最大學名藥市場,而新興市場如印度、中國等則最具發展潛力,顯示中國學名藥市場成長率將高於8.7%。
根據IMS統計,2015年中國已晉升為全球第二大學名藥市場。
中國化學製藥協會資料顯示,2015年中國學名藥市場市場規模約為5,000億人民幣(約750億美元),約為2015年中國半導體市場整體規模的五分之二。
承前文所述,中國一連串藥改制度讓中國學名藥產業正式面臨全面洗牌。但另一方面也為全球第二大學名藥市場騰出空間,讓具備能力與條件的企業有了新的機遇與發展潛力。
藥政改革新制下,台灣進軍中國學名藥市場究竟有那些致勝關鍵?那些法規必須掌握透徹?
新制學名藥註冊分類
首當其衝的是化學藥品註冊分類調整的新辦法。
2016年3月,中國食品藥品監督管理總局(CFDA)頒布《總局關於發佈化學藥品註冊分類改革工作方案的公告》,重新調整化學藥品註冊分類,其中台灣學名藥廠若是本身或其合作夥伴在中國設有生產基地,則將以3、4類進行註冊;其餘則是透過第5分類進口的方式進軍中國市場。(參見表一)
但觀察中國目前藥制改革的項目,目前仍以3、4類國產學名藥為主要支持對象,第5類進口類別則仍未受到相對應的關注,意味著台灣藥廠若要進軍中國,應盡量採取3、4類註冊方式進行。
目前,中國針對優質藥廠也頒布許多獎勵及保障政策(參見表二)。其中,若學名藥廠具備有美國食品藥物管理局(FDA)核准上市的藥項,且以中國當地的廠房進行生產,則有機會直接「視為通過一致性評價」,並進一步加快4~6個月的審批速度。
另外,若為中國首家申請註冊的品項,則將視為首仿品種,可取得優先審批資格。根據中國中信證券分析估計,一般從申報參比試劑到最後評審審批,最快需要22個月,但若是符合優先審批,則有機會大幅加快至12-18個月。
根據上述,本刊綜合專家之觀察,台灣學名藥廠進軍中國市場營運的關鍵因素可依上市核准前、後不同階段策略。(參見表三)
其中,上市核准前之關鍵在於如何加速報批以及後續政府審批的速度,一旦取得中國上市核准後,則在於如何確保藥項能夠有效在中國市場銷售。另外,若台灣藥廠能取得具醫療背景的中國股東,或可借助股東之力拓展中國市場。
何謂一致性評價
其次,影響未來中國學名藥產業最鉅大的新制法規之一,莫過於2016年5月頒布的《國務院辦公廳關於開展學名藥品質和療效一致性評價的意見》有關事項的公告(2016年第106號)以及9月《推進學名藥一致性評價提升行業發展水準――學名藥品質和療效一致性評價有關政策解讀》。
其分別指出,一旦第一家學名藥廠的品項通過後,3年內不再受理其他學名藥廠相同品項的註冊申請,且通過新標準審批後將優先進入集中採購名單,若超過3家以上通過,則不在選用未通過的品項,意味著一旦第一家學名藥廠的品項通過後,該品項將在3年內確定該主要學名市場。
究竟何謂一致性評價?依據《國務院辦公廳關於開展學名藥品質和療效一致性評價的意見》(2016年第8號),學名藥品質和療效一致性評價簡稱一致性評價,與先前學名藥審批最大差異在於保障藥品安全性和有效性,主要是為了提升中國製藥行業整體水準,促進醫藥產業升級和結構調整,增強國際競爭能力。(參見表四)
...