哺乳動物中有一組極早期基因(immediate-early genes,IEG)會編碼與生長因子、神經元和免疫刺激有關的包括:Fos、EGR和NR4A家族轉錄因子,這些因子的半衰期短,在接受刺激時會高度表現、快速消失,在生理上扮演重要角色。
而當IEG表現失調時就會導致癌症、免疫缺陷和神經系統疾病,但在正常情況下,有問題的IEG在轉譯成蛋白質後就會迅速被蛋白酶體降解。
不過有科學家提出,這個降解過程,通常會透過泛素化依賴(ubiquitination-dependent)的機制來達成,但也有蛋白在未泛素化的情況下被降解。
然而如何協調這個分子事件走向泛素化依賴或非依賴,進而被蛋白酶體降解的過程,科學家至今對其仍不甚了解。
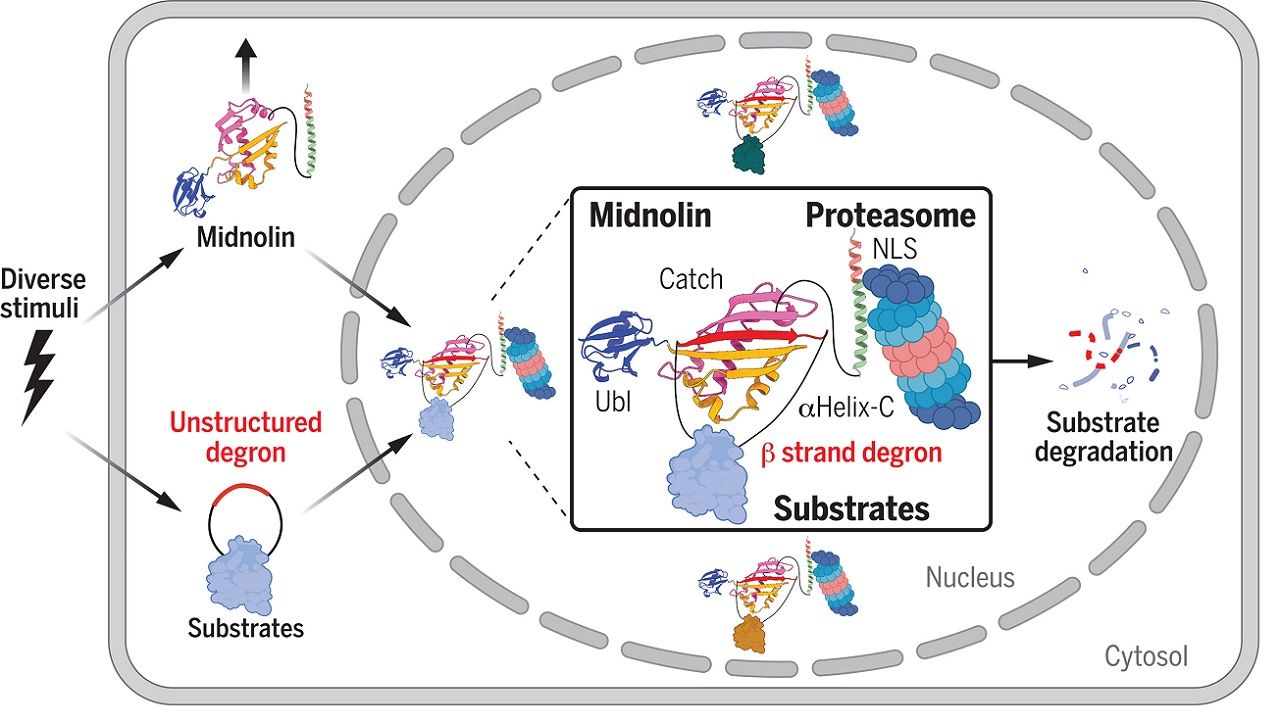
為此哈佛醫學院研究團隊利用CRISPR-Cas9技術進行全基因體功能缺失(loss-of-function)的篩選,其研究發現在哺乳動物細胞核中有一個未被鑑定過(uncharacterized)的蛋白—Midnolin,在高表現情況下,可不需要透過泛素化的機制,促使數百種目標蛋白(substrates),如:c-Fos、FosB、EGR1和NR4A1等被蛋白酶體降解。
(圖片來源:Science)
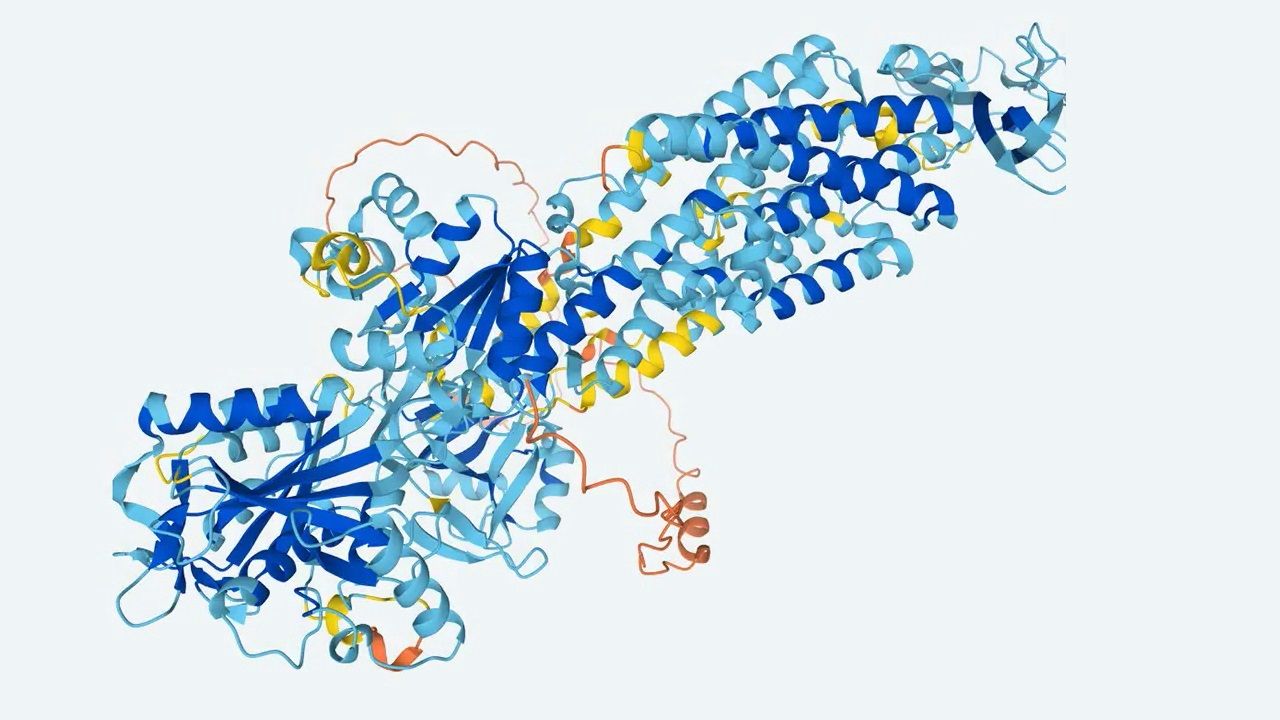
而為了進一步了解Midnolin如何靶向和降解如此多種蛋白,研究團隊也藉助DeepMind發布的蛋白質結構預測機器學習工具AlphaFold與一系列實驗結果,證明Midnolin具有一個「捕獲域(Catch domain)」可與目標蛋白結合。
此外,當Midnolin與目標蛋白結合後,Midnolin也會伸出β 鏈抓牢目標蛋白,Midnolin並透過C端的α 螺旋與蛋白酶體穩定結合,促使目標蛋白降解。
研究人員表示,這項研究證明Midnolin-蛋白酶體的機制可繞過典型的泛素化系統,在細胞核內實現蛋白質降解,而我們也正在積極探索該領域是如何調整機制的特異性,讓Midnolin能降解感興趣的蛋白。
資料來源:https://www.eurekalert.org/news-releases/998812
(編譯/彭梓涵)