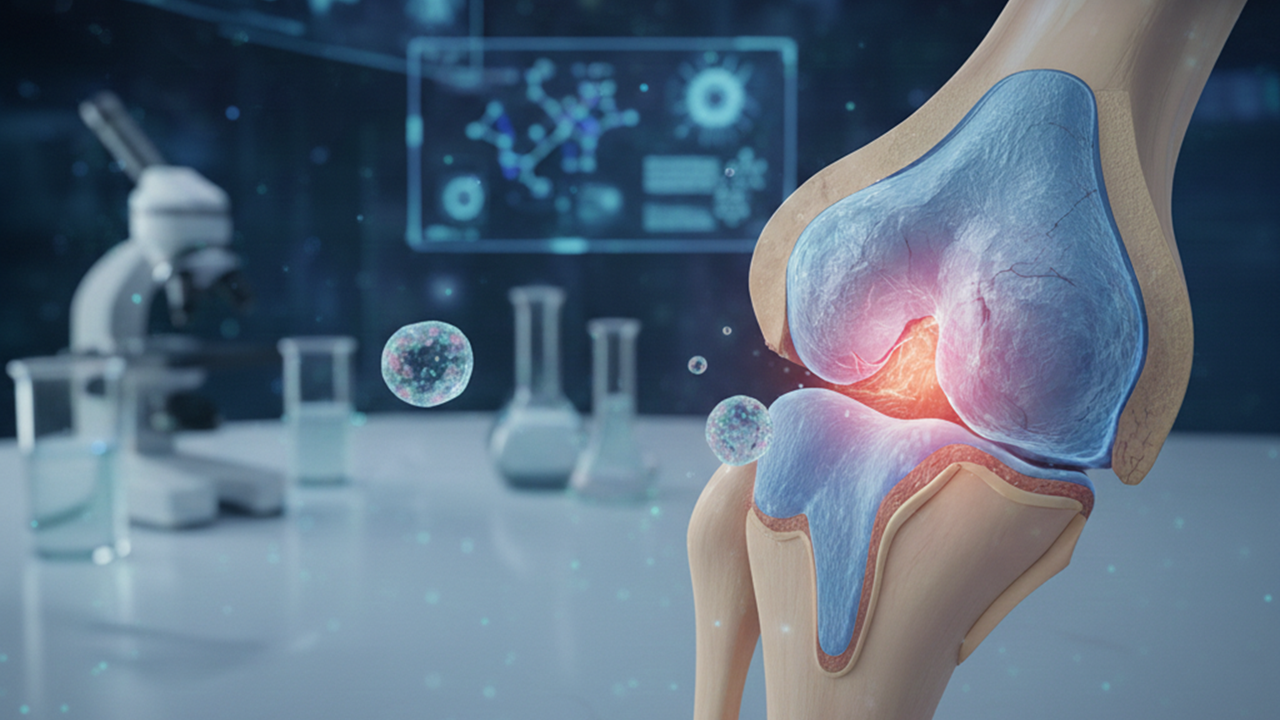
美國時間1月14日,麻省總醫院暨布萊根醫療體系(Mass General Brigham)研發出一種基質反向標靶(matrix inverse targeting, MINT)奈米載體平台,能夠透過軟骨退化過程中自然變化的糖胺聚醣(glycosaminoglycans, GAGs)訊號,感知軟骨受損的位置,並將mRNA療法精準遞送至病灶區域。研究結果已發表於《Nature Nanotechnology》。
骨關節炎(Osteoarthritis, OA)是一種常見的退化疾病,其特徵為軟骨受損,並伴隨關節疼痛與慢性發炎反應,然而,目前尚無獲得美國食品藥物管理局(FDA)核准的療法。
近年來,以RNA為基礎的治療策略展現出高度潛力,但由於骨關節炎在不同病人之間的病變程度差異甚大,如何精準標靶病灶並有效遞送藥物成為一大難題。
在這項研究中,團隊設計出一種具備MINT性質的奈米粒子,利用軟骨退化過程中的生化訊號來標靶骨關節炎病灶。其運用的標靶策略,是針對健康的軟骨富含GAGs,會使組織帶有強烈的負電荷,但隨著骨關節炎惡化,GAGs會逐漸流失、使組織的負電性降低,而MINT奈米粒子會被富含GAGs的健康軟骨排斥,同時被GAGs流失的病灶區域所吸引,藉此標靶出正在退化的軟骨。
MINT奈米粒子的標靶,使研究團隊得以遞送編碼飢餓素(ghrelin)的mRNA。研究團隊在骨關節炎的小鼠臨床前模型中,證明裝載飢餓素mRNA的MINT奈米粒子,可有效減緩軟骨退化、限制軟骨下骨增厚、降低發炎訊號,並減少與疼痛相關的神經網路活化。
研究團隊表示,未來將進一步研究延長治療效果的持續時間、驗證與更多RNA載荷的相容性,以及在膝關節更接近人類的大型臨床前試驗模型中進行測試,並評估MINT技術邁向臨床治療的可能性。
研究團隊也指出,MINT平台技術不僅突破了骨關節炎治療長期以來的遞送瓶頸、將治療集中於受損的病灶區域,並隨疾病進展而動態調整,也因為MINT的標靶機制依賴的是組織內的生化訊號變化、而非人為設計的配體,因此具備高度通用性,未來有望應用於多種RNA治療,甚至拓展至其他以基質降解為主要病理特徵的疾病標靶治療。
(編譯/實習記者 康育華)