CAR-T療法自2017年首次獲得美國食品藥物管理局(FDA)批准後,中國國家藥品監督管理局(NMPA) 才於今年6月、9月分別批准兩款CAR-T療法,一是Gilead旗下Kite製藥研發的Yescarta,該藥是由復興醫藥持股50%的復星凱特於2017年引進,經技術移轉於中國生產。
另一款則是由中國藥廠—藥明巨諾自主研發,靶向CD19的CAR-T療法,該療法是中國國內唯一被納入國家重大新藥研發計畫的CAR-T產品,同時也獲得NMPA優先審查資格和突破性療法認定。
加上藥明巨諾這款CAR-T療法,現階段全球共有6款CAR-T藥物獲得批准上市。包括:首款由諾華(Novartis)開發的Kymriah、以及Gilead旗下Kite製藥的Yescarta和Tecartus、必治妥施貴寶(BMS)的Liso-cel、BMS與Bluebird共同研發的Abecma。
適應症大致可分為瀰漫性大B細胞淋巴瘤(DLBCL)、被套細胞淋巴瘤(MCL)以及多發性骨髓瘤(MM)等。
GlobalData表示,中國一直在透過最新的生物製劑註冊規定,讓申請的療法有機會獲得優先審查資格並確保產品更快獲得批准。
在中國,目前有25種CAR-T療法,正在進行臨床2期試驗,且大部分是靶向CD19的CAR-T療法,並定位為2線或3線的治療。
「中國已成為亞太地區CAR-T療法發展最快的國家,且數量超過美國。」GlobalData指出。
然而隨著更多屬於是靶向CD19的CAR-T療法進入臨床2期,GlobalData認為,中國的CAR-T療法可能會因缺乏差異化而面臨激烈的競爭,並可能引發進一步的關注。
CAR-T療法屬於個人定製化藥品,該療法透過採集患者T細胞,進行體外基因工程修飾,再回輸給患者,使T細胞可以識別特定腫瘤靶點,活化自身免疫力將腫瘤置於死地。
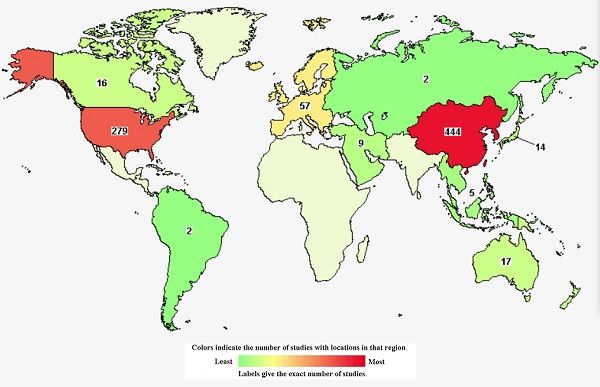
(圖為登錄於ClinicalTrials.gov上的CAR-T臨床試驗狀況)
資料來源:https://www.globaldata.com/faster-approvals-likely-make-car-t-landscape-competitive-china-says-globaldata/
(編譯/彭梓涵)

.jpg)







