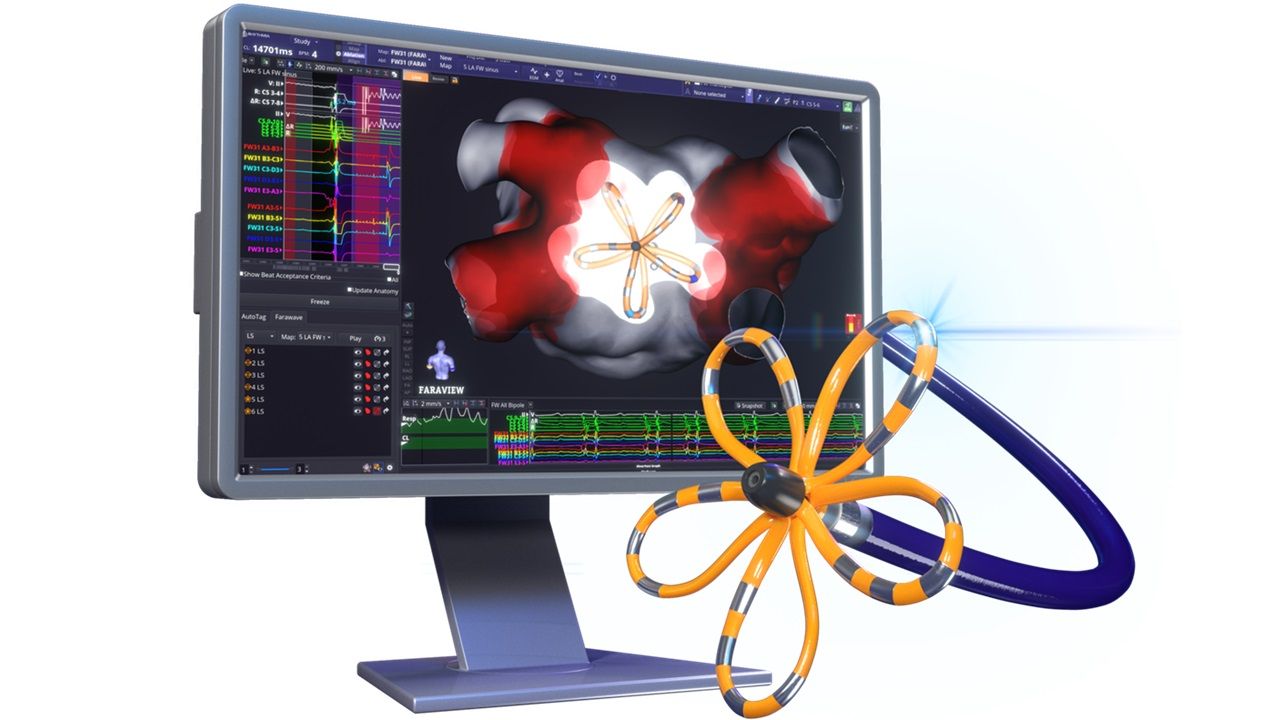
美國時間21日,波士頓科技(Boston Scientific)宣布,其FarawaveTM Nav磁導航探頭獲美國食品藥物管理局(FDA)批准。該探頭與第一代心臟脈衝場消融(PFA)系統FarapulseTM結合,即可在單一導管中完成心臟測繪和PFA治療,迄今,該技術已完成逾12.5萬例間歇性心房顫動(AFib)手術。
心房顫動是一種心律異常疾病,會導致心跳不規則且過快。隨著全球人口老化及高血壓、肥胖等生活方式相關風險因素的增加,AFib病例數量持續上升。當前技術利用微秒級脈衝電場,提高了手術的精確度與安全性。
波士頓科技FarawaveTM Nav磁導航探頭,使醫生能夠實時查看脈衝場應用的位置,累積臨床經驗,並優化消融策略。此外,自動標記技術還能幫助醫生規劃、執行並確認治療過程。不過,波士頓科技仍面臨激烈的市場競爭。
目前,PFA市場主要競爭者包括波士頓科技、美敦力(Medtronic)、亞培(Abbott)、嬌生旗下的Biosense Webster、Pulse Biosciences、Kardium、佳靖電子股份有限公司(Jia Jing Electronic Co., Ltd.)。各家公司不斷推出創新技術,角逐這一迅速增長的市場。
波士頓科技是最早提出將PFA技術應用於心臟治療的公司。美敦力則於2023年12月憑藉其PulseSelect系統成為全球首個獲得FDA批准的PFA系統供應商。隨後,波士頓科技的Farapulse系統於2024年2月也成功通過FDA認證,成為全球僅有的兩家取得此認證的公司之一。
在擴展市場的策略上,波士頓科技於2024年1月完成了對美敦力競爭對手Axonics的收購,進一步進軍泌尿系統市場,展現其在醫療科技領域的積極擴張與佈局。
此外,亞培於2024年10月推出了FDA批准的AdvisorTM HD Grid X標測導管,該產品提供首創的高密度電極配置,協助醫生在心臟消融過程中,無論導管位置如何變動,仍能精確檢測心臟電訊號。
嬌生旗下的Biosense Webster的VARIPULSETM導管於2024年2月獲得歐盟CE標誌批准。該導管屬於CARTOTM整合式脈衝場消融平台,由TRUPULSETM產生器供電,旨在提升手術的即時視覺化、回饋功能及精確度。
隨著技術競爭加劇,PFA技術的發展將繼續推動心房顫動治療領域的進步,造福更多患者。全球廠商將持續投入資源,推動技術創新與市場拓展。
參考資料: https://www.fiercebiotech.com/medtech/boston-scientifics-navigation-equipped-pulsed-field-ablation-catheter-passes-fda
(編譯/黃佳啟)


- Global Bio and Investment Monthly
- 讀者服務電話:+886 2 2726 1065時間:週一 ~ 週五 09:00 ~ 18:00
- 服務信箱:[email protected]
- 地址:110臺北市信義區信義路六段29號2樓之一, Taiwan
- Copyright© 2024 環球生技多媒體股份有限公司. All rights reserved.本文內容受著作權法保護,如有引用請註明出處。授權申請。隱私宣告Privacy。會員條款User Terms。
為了提供您最佳的服務,本網站會在您的電腦中放置並取用我們的 Cookie,若您不願接受 Cookie 的寫入,您可在您使用的瀏覽器功能項中
設定隱私權等級為高,即可拒絕 Cookie 的寫入,但可能會導至網站某些功能無法正常執行 。