Susvimo與羅氏專利已到期的AMD暢銷藥Lucentis (ranibizumab)具有相同的活性成分,Lucentis是一款每月給藥一次的VEGF抑制劑。
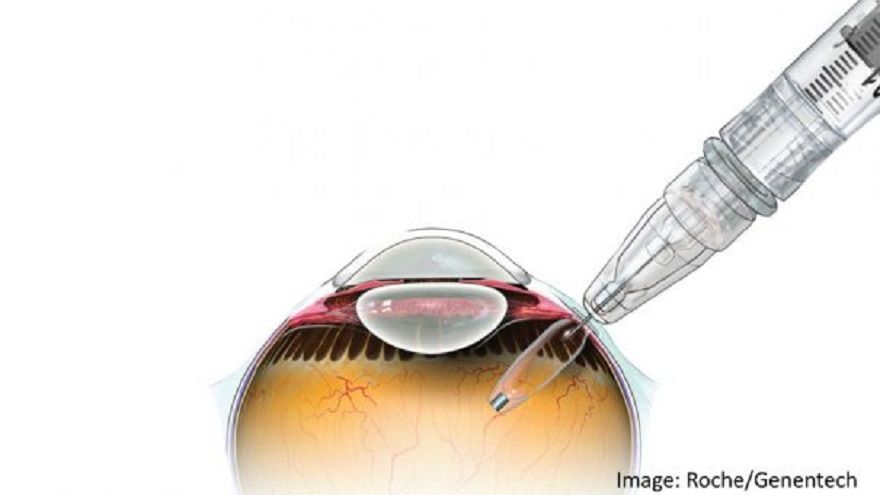
Susvimo則是透過一款僅有米粒大小的新型植入給藥系統—Port Delivery System,此方法是目前同類藥物中的首創技術,給藥系統會植入患者下眼瞼,系統內填充藥物,可不斷遞送藥物至少6個月,患者僅需每6個月補充一次。
FDA此次批准是基於一項ARCHWAY的臨床三期試驗,結果顯示,Susvimo可維持患者40周以上視力,且效力與每月注射0.5mg的Lucentis相同。
羅氏表示,Susvimo的定價,為第一次植入時收取9,250美元,補充藥物則為8,000美元,相較Lucentis每月劑量定價約1,230美元,整年總價貴一些。
目前在AMD市場中競爭激烈,除了羅氏的Lucentis、還有都是三個月給藥一次的Regeneron的Eylea、和諾華(Novartis) 的Beovu。
羅氏的Lucentis也會因專利到期,將受到來自三星集團Samsung Bioepis/Biogen、Hospira和 Formycon/Bioeq等公司的生物相似藥競爭。面對目前的競爭挑戰,羅氏能否透過新型改藥方式,扭轉目前情勢,還屬未知。
不過除了將新型藥物遞送系統用於AMD,羅氏也將其擴展到其他眼科產品線,包括治療AMD和糖尿病黃斑部水腫(DME)的雙特異性抗體faricimab。
該臨床試驗最快於明年初會有結果,若進展順利,該療法也將成為首個,一次可治療由Ang-2和VEGF-A兩種機制引起的視網膜疾病。
資料來源:https://www.fiercepharma.com/pharma/fda-green-lights-genentech-s-eye-implants-for-macular-degeneration-will-it-be-a-tough-sell
(編譯/彭梓涵)