一次世人都不想碰到的流行疫情,在不到三個月時間裡,就把臺灣過去努力數十年的外交進展,推到歐美各國領袖都不得不把臺灣收進眼底,31個國家的媒體都對臺灣進行了讚譽報導。
儘管,新冠肺炎境外移入確診案例持續增添,瞬間升高了國人對疫情的緊張,但相較包括美、英在內的強權國家防疫線不斷崩塌,就算臺灣一樣也出現物資搶購躁動,也依然是國際眼中的模範生。
週末,大灣區一位生物醫藥產業權威組織領導前輩,微信傳來了一段廣播,還特別語音留言:「小明、小明,這是最值得聽的全球疫情分析與臺灣的驕傲,是中國的報導,你一定要聽聽。」(我上網查了一下,是中國的一個評論直播,這天題目是:「各村各有高招,成績最好的,你可能想不到」)
防疫韓、日、臺三模式 誰該「抄」誰的作業
「誰該『抄』誰的作業」,直播講了多國的防疫動態,其中又特別推崇韓國、日本防疫模式,尤其是韓國。
直播認為韓國民族性脾氣急、做事也極端,所以韓國總統文在寅很快宣布「國家陷入戰爭狀態」,迅速地設置了50站Drive Through 快篩檢測站,「把所有的確診都給我找出來」,每天檢測可達15,000人數,然後要民眾配合下載app,檢測20分鐘後,透過手機通知結果,不僅把確診病患揪出來,並且改造軍隊的醫院加之隔離。
韓國又動用堪稱滴水不漏的街頭攝影(報導同時表示:當然也把韓國政權對民眾掌控的這張網揭了開來),加上民眾app裡設計的定位追蹤、控管無所遁形,靠著超高的行政效率,韓國現在已經控制住疫情。所以以色列、美國後來都「抄」了韓國,也投入了快篩。
不過,報導認為最「了不起」的,還是臺灣模式,稱道臺灣「料敵於先、行政處置果斷、內部井然有序」,政府對疫情判斷比中國鍾南山教授更早,武漢還沒封城前,就對武漢入境班機進行檢疫,接著斷然禁止往來航班;徵用媒體頻道,每小時播放防疫公衛教育和信心喊話;快速透過產業徵收以確保臺灣防疫物資充足;還有個讓人民幸福的臺灣健保制度,得以快速實施實名制口罩分配。
「這每條做法乍看之下都沒什麼,但細節都非常到位,這位行政院蘇貞昌院長,我這次真是對他刮目相看,一看疫情不對勁,決策判斷之果決、口罩禁止出口又同步對產業徵收之『快』、之『狠』哪!但是,安了人民的心……。臺灣這次防疫,真是讓同樣身為中華民族的一份子覺得驕傲。」
小明聽完後,又分享給幾位中國老朋友。其中有一位畢竟曾經是藥監局領導,掌握政策重點又快又準,聽到小明還在截稿死期中,竟很快幫小明做了功課,整理了一個「抗擊疫情三模式」的韓、日、臺三國比較Excel檔,也在此跟大家分享。(如附表)
「一切照正常審查程序來」
是的,大家都不忍苛責政府了,也許正因為疫情控制的好,案例也不夠多,許多檢測業者難有用武之地,只能搖頭嘆氣。
雖說,政府二月間就召開盤點國內檢測業者能量及溝通會議,但眼見歐、美政府都開出綠色通道,緊急授權(Emergency Use Authorization, EUA) 讓有能力的檢測及快篩業者投入防疫,臺灣多組學界及多家業者雖然開發出檢驗方法,不過,落地應用仍不見任何公司有下文。
「一切要照正常審查程序來,政府暨不提供檢體供做臨床確效(Clinical Validation),又沒有緊急使用授權,讓業界完全沒有參與防疫的空間。」業者說。
依據《藥事法》第48-2條規定,因應緊急公共衛生情事需要,中央衛生主管機關得專案核准特定藥物之製造或輸入,這是國內類似美國EUA的機制。但是業者又指出,「我們也問過了,GMP文件一個都不可少。但美國EUA可以允許沒有,Stability Data (穩定性數據)要有計劃書即可。」
一位曾任政府部門主管也分享,「美國EUA的精神不在以往有無GMP,而在此時能否應疾與應急,包括美國醫學中心CAP CLIA 實驗室也會與EUA 內建Interactive (互動)機制,審查單位與廠商公私合作、解決問題,同步提昇法規科學及產業能力。」
一個多月又過了,看到、聽到很多業界朋友抱怨了也沒用,有資深前輩不禁感慨,「政府聽醫界,只用成熟的外國產品,防疫優先尚可以理解,但若連做實驗驗證都不支持,將完全喪失了扶植生技產業的好機會。」
政府應組成「檢驗套組國家隊」
國家衛生研究院李敏西研究員表示,臺灣已很難將新冠病毒阻擋於邊境,一旦社區流行開始發生,不積極防疫違背人道,但大量且長期的檢疫隔離,將嚴重影響社會功能及經濟活力,因此,應善用檢驗科技來提升防疫效率,非常重要。
李博士提到,病毒感染常用的檢驗方法包括病毒核酸、病毒蛋白及血清抗體,如何將三種常用的檢驗方法應用在防疫需考慮檢驗時效、檢驗時間及價格等三因素,檢驗時效方面:病毒核酸最早、病毒蛋白其次、血清抗體最慢;檢驗時間方面:病毒核酸較慢約需1~4小時,病毒蛋白及血清抗體檢驗較快 (小於1小時) (請見示意圖中的T1、T2及T3)。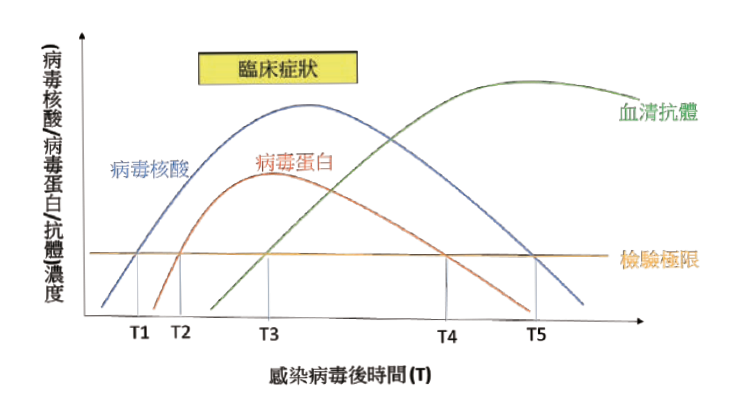
這三種檢驗方法也各有其醫學意義及應用,目前確定病例接觸者及國外入境者需隔離或檢疫14天,未來大量社區流行時,將耗費巨大檢驗費用及衍生經濟蕭條,如果在不同時程搭配使用不同檢驗方法,將可大幅減少檢驗費用及縮短隔離檢疫時間;此外,對於制定住院確診病例出院指標,及無症狀確診病例解除隔離指標,結合病毒蛋白及血清抗體檢驗可能比病毒核酸檢驗更有意義。
傳染病檢驗套組是防疫重要的一環,近月來,國內已開發出多組相關檢驗方法,但依醫材法規必須完成臨床驗證,才能取得上市許可。
只是,目前新冠病毒檢驗只在疾管署指定的醫療院所進行,現在國內確診病人四散不同醫院,此時若無政府介入,任何檢驗套組都很難在此時快速完成臨床驗證。
政府應善用此次新冠病毒大流行的契機,加速扶植相關產業。為了加速其上市及大量生產,政府應組成「檢驗套組國家隊」,整合疾管署、食藥署、經濟部、產業界及學研機構等來完成臨床確效、上市審查及大量生產,產品上市後應暫時統一由政府收購及分配,待供應無虞後才開放自由買賣。
他也建議,進行臨床驗證時,最好是針對不同臨床表現的病人收集不同時期的檢體,然後使用這些檢體比較不同的檢驗套組,這些實證資料對於制定防疫政策非常重要。
李敏西博士在我們定版後投了一篇稿:「如何善用檢驗科技提升新冠病毒防治效率」,由於時間關係,加上我們Daily App及線上新聞已連續排程國際快篩防疫檢測的相關報導,所以,致歉之餘也特別在此分享以上李敏西博士的精要觀點。
「政府就是不願意麻煩」
「對產業界來說,每一天都很重要,大家從兩個月前就在這裏等檢體、等審批、等科技計劃……,已經等了兩個月,無法前進。政府仍開自己的會,一個接一個,就是不知道如何能前進?」。
(註:食藥署醫療器材及化粧品組已於2020-03-26公告發布「新型冠狀病毒檢驗試劑申請專案製造諮詢專線03-573-2625 黃小姐,分別也準備了「新型冠狀病毒核酸檢測專案製造參考文件」及「新型冠狀病毒快篩試劑專案製造參考文件」供有意願廠商詢問索取。」https://www.fda.gov.tw/TC/siteListContent.aspx?sid=310&id=32908)
業者感慨:「大多數國家,都很懂得儘量借重產學界的能量,也是給業者機會。但是,臺灣政府常常有很多方式明明可以協助業界進行,就是不願意麻煩。例如,只要有臺灣EUA 許可,業者檢測產品就可以用到其他國家去,現在TFDA發佈了參考文件,但也已經晚了兩、三個月,且後面還要看如何審批及速度。」。
還有院士級前輩也提及,「我實驗室有所有冠狀病毒的N proteins可以當快篩抗原,可惜……」。
反觀,以中國華大基因為例,檢驗產品和臺灣多家業者都一樣的標準Rt-Pcr,按照標準的新冠病毒檢測位點所設計的Assay,但中國國家藥品監督管理局(NMPA)不到兩個星期就通過審批,讓他們快速投放市場。據業者透露,該公司過去幾週出貨忙得沒時間睡覺,大賣日本和歐美,光日本短短一、兩週就能賣兩、三千萬新臺幣。
現在,歐洲市場有迫切需求,但臺灣廠商就算有更好的技術,似乎眼前一個都進不去,「我想,臺灣防疫做的太好了!可能沒有考慮到臺灣業界真正參與的事實。」。
聽到前輩如此結論,小明看到滿天飛過的金條,一想到臺灣檢測產業卻抓不到半條,更想啜泣了……