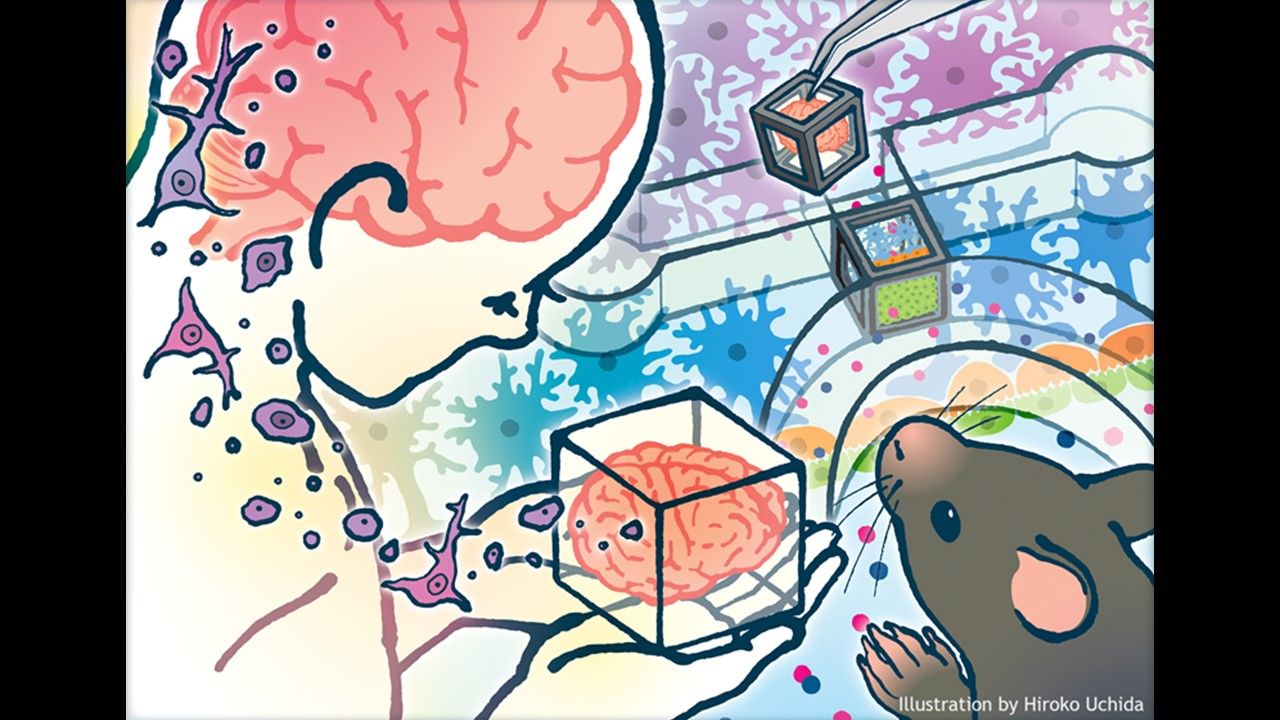
昨(28)日,日本理化學研究所(RIKEN)生命機能科學研究中心(Biosystems Dynamics Research, BDR)發表類器官最新研究成果,其利用人類細胞衍生的模組化組織,建立了血腦障壁的體外模型。研究團隊將其設計的平台稱為「箱中組織」(Tissue-in-a-CUBE),它能應用在藥物發現(drug discovery),並能作為臨床前研究的動物模型替代方案。此研究已發表在《Communications Biology》。
研究團隊在邊長5 mm的立方體框架中,充填了混入由人腦衍生之星形膠質細胞(astrocytes)和周邊細胞(pericytes)的水凝膠,再於表面植入從人類多潛能幹細胞(iPS細胞)分化出的血管內皮細胞,以形成細胞層片(cell sheets)。
帶領此研究的萩原將也(Masaya Hagiwara)表示,這項類器官裝置能夠在結構與功能上,準確模擬真實的血腦障壁。不僅裝置內的星形膠質細胞和周邊細胞,會在內皮細胞層下的三維空間延伸,且透過基因表現和功能分析,也確認了血腦障壁模型中的緊密連結(tight junction)和運輸蛋白等構造,就像是真的血腦障壁,只讓有限的物質通過。
此外,此裝置的框架能夠用鑷子操作,便於移動和處理,細胞培養程序則能在常規的細胞培養盤完成。在組織成熟之後,便能和其他培養好的組織整合在一起,在團隊先前建置完成的「箱中組織」模組化平台中,分析組織間的交互作用。
為了驗證這項裝置在藥物發現的用途,研究團隊執行了藥物篩選實驗。他們在另一個框架中,培養了膠質母細胞瘤(glioblastoma)細胞、製作成腦瘤模組,再與血腦障壁模組組裝在一起、轉移到流體晶片中並完成連接,再施加化療藥品Vincristine。
結果顯示,通常Vincristine無法輕易穿過血腦障壁,但在加入傳輸蛋白功能抑制劑後,便能暫時性讓Vincristine穿過、進而殺死腦瘤細胞。研究團隊表示,這項裝置讓科學家能夠確認有多少抗癌藥物能夠穿過血腦障壁、抵達腦瘤。
萩原將也表示,這種創新方法讓科學家在必要的藥物開發測試中,獲得一種新的動物實驗替代方案,了解藥物行為、有效性及安全性。這種模組化平台也能應用在各種疾病,例如阿茲海默症和帕金森氏症等與年齡相關的神經退化性疾病。他們也計畫在未來能夠模組化、重現不同類器官之間的連結。
目前,在臺灣,也有臺北醫學大學生物化學劑細胞分子生物學科曾厚教授,投入新式片狀細胞結合微流道晶片模擬腦血屏障之器官晶片的研究。
參考資料:
https://www.genengnews.com/topics/drug-discovery/tissue-in-a-cube-system-models-blood-brain-barrier/
(編譯 / 吳培安)