背景
目前藥品的製造模式主要是集中於大規模的生產後再分銷至全球網絡,在此種集中大量的製造模式下,製造工廠可標準化確保產品品質的一致性並可集中採購降低成本。此種模式的運作主要支持關鍵在於製造過程中無論是關鍵原料、包裝材料或最終產品等都需仰賴穩定便捷的運輸配送系統。
由於近年在新冠疫情大流行期間,運輸系統受阻,加上美中貿易戰,打亂了國際供應鏈秩序,全球製藥產業供應鏈出現重組趨勢,導致集中生產製造模式失靈,因此各國紛紛推動創新靈活的生產模式—分散式生產製造。
分散式製造(Distributed manufacturing, DM)即是運用一個以上的製造地點來風險分散,使藥品製造商能夠迅速增加產量,而不受特定供應鏈中斷的影響,當單個製造地點發生災難性事件,則可以將下游供應鏈和客戶的影響降至最低。這些製造站點(Portable on Demand, POD)可以分布於任何國家或地區,規模通常小於中央製造基地,且每個站點的設備都由中央製造基地監管,以確保製程一致與產品品質。而分散站點的戰略考量,是要能在更靠近使用點的地方生產藥品,來增加藥品的可及性,進而減少長途運輸和配送的需要1。本文擬介紹新生產模式下、國際的監管法規機制是如何設計。
國際趨勢
DM這個概念最先出現於美國食品及藥物管理局﹙Food and Drug Administration, FDA﹚之藥品評估暨研究中心(Center for Drug Evaluation and Research, CDER)於2022年10月17日提出的《監管先進製造評估框架》(Framework for Regulatory Advanced Manufacturing Evaluation, FRAME)倡議。此倡議中考慮了四種先進製造技術:(1)端到端連續製造(End-to-End Continuous Manufacturing, E2E CM)。(2)分散式製造(Distributed Manufacturing, DM)。(3)照護點製造(Point-of-Care Manufacturing, POC)。(4)人工智慧(artificial intelligence, AI)。FDA表示FRAME倡議的監管規範會儘可能的與目前所引用的國際指引一致,像是上述四種技術中E2E CM與最新ICH Q13原料藥和藥品的連續製造指引是一致的。其餘的技術CDER後續也可能會發布新的指引來解釋目前技術與監管的注意事項,以使實施先進製造的相關業者有明確的規範依循。
|
先進製造技術 |
說明 |
|
端到端連續製造 E2E CM |
一個整合的製造流程,其原材料不斷進料和轉化,成品藥不斷取出。 |
|
分散式製造 DM |
分散的製造平台,其製造單元可以部署到多個不同地點。 |
|
照護點製造 POC |
分散式製造的變化形,製造單元更靠近病人照護的位置(非傳統製造規範界定的場所);例如在醫療機構或診所製造。 |
|
人工智慧 AI |
可以感知環境、分析資料和決定行動的軟體和硬體系統。 |
歐盟於2023年4月26日提出的《歐盟製藥立法改革》(Reform of the EU pharmaceutical legislation)草案中也針對於保存期限短或自體先進醫療產品(Advanced therapy medicinal products, ATMP)和其他由人類物質組成的藥物產品,引入了分散式製造規範,戰略性地將藥品生產製造地點靠近病人,可以使最終產品更快、更安全的到達整個歐盟的使用者手中。
依據該提案,分散式製造的中央站點必須負責2:(1)許可證申請,(2)需向各分散站點成員國的主管機關進行分站點的註冊,並向歐洲藥品管理局(European Medicines Agency, EMA)登記。若分散站點有執行人類物質來源的醫藥產品,則需依據《用於人類應用的人類來源物質品質和安全標準》來設立。(3)由於各分散站點不需取得製造許可,因此中央站點必須有授權證明文件,並證明各站點符合GMP規範且定期查核與驗證。且各站點的生產製造僅能執行中央站點授權的產品製造。(4)中央站點必須對分散站點生產的藥品品質與產品的一致性負起責任。而各成員國的主管機關必須監督管理國內的分散站點,允許監管機關在未通知的情形下進行現場查核,或執行遠距查核,也可與中央站點的主管機關一同前往查核,以確保產品品質。
圖1: 歐盟分散式製造之監管概念
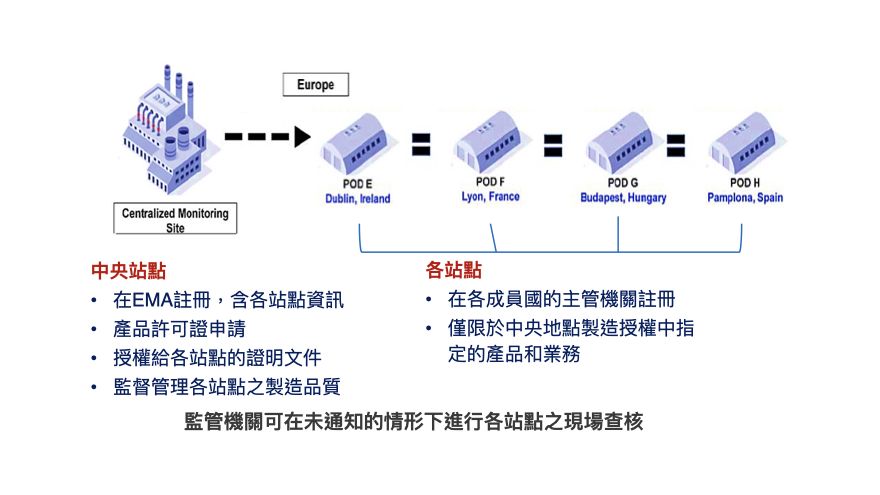
(資料來源:資策會科法所整理製作)
結論
分散式製造已成為藥品製造模式之新趨勢,臺灣在發展創新生物製造技術,承接國際訂單因應國際需求時,無論是以國際合作夥伴的分站站點或自己設立中央站點的模式,都需建立高效率的供應鏈管理系統。像是運用自動化來提高生產力和品質管理,並加強現場人員的培訓和資格認證,或是運用數位化的監測系統,以動態即時的協調並監控多個不同站點之製造品質;與此同時,亦需評估製造規範調整之需求。
參考資料:
1. Marquerita Algorri, Michael J. Abernathy, Nina S. Cauchon, Re-Envisioning Pharmaceutical Manufacturing: Increasing Agility for Global Patient Access (Aug. 31, 2021), https://www.sciencedirect.com/science/article/pii/S0022354921004652 (last visited June 13, 2023).
2. Robin Blaney, Yuliya Gevrenova, EU Pharma Legislation Review Series: Decentralized Manufacturing, Inside EU Life Sciences (May 3, 2023), https://www.insideeulifesciences.com/2023/05/03/eu-pharma-legislation-review-series-decentralized-manufacturing/?_gl=1*nc0cqv*_ga*MjEyMTUwODEyMS4xNjg2ODAxMjQw*_ga_KSNMJSN08X*MTY4NjgwMTIzOS4xLjAuMTY4NjgwMTIzOS4wLjAuMA (last visited June 13, 2023).
(撰文/資策會科技法律研究所 陳怡錦 法律研究員)









