東協區域聯合評估機制助降低藥品跨國上市重複審查成本及時間
2025-12-02 / 資策會科法所
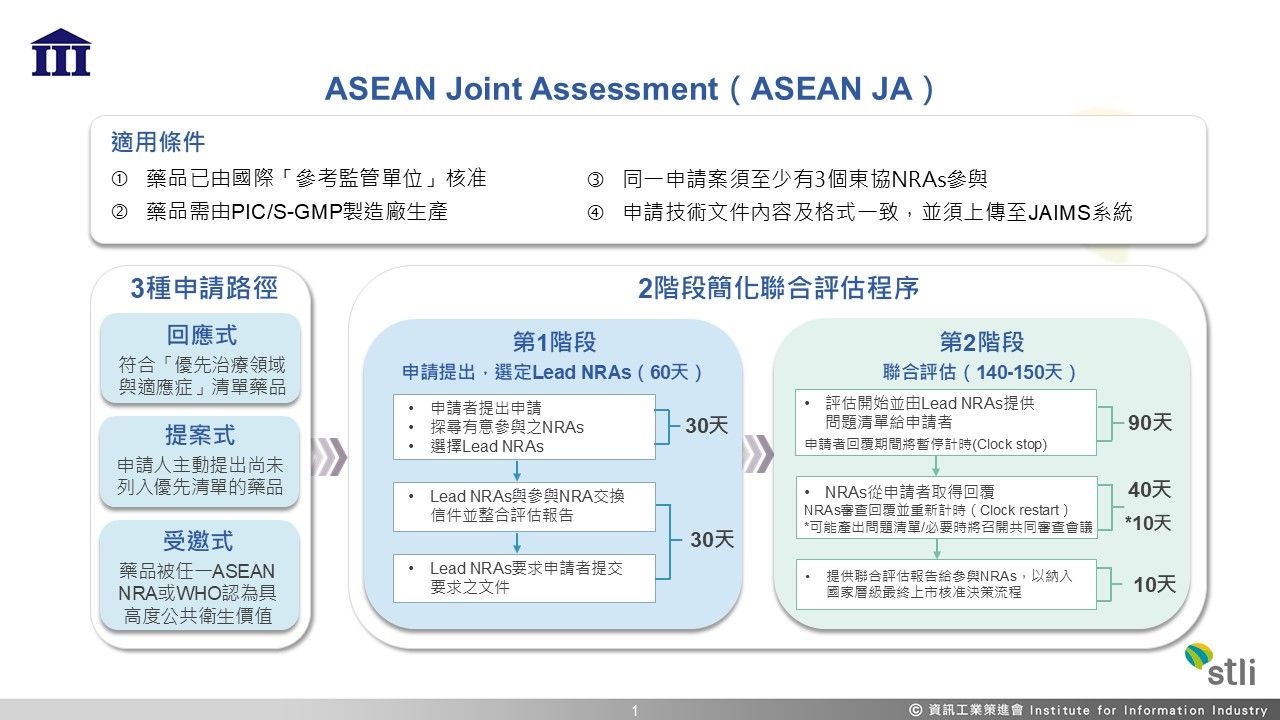
製藥公司在拓展海外市場往往面臨各國單獨審查、資源分散、上市申請審查時間冗長等挑戰,可能導致錯過搶占市場之先機。東協聯合評估(ASEANJointAssessment,ASEANJA)接受同一藥品可同時提交至少3個參與東協會員國藥品監管單位(NationalRegulatoryAuthorities,NRAs)之上市審查申請,由各NRAs國聯合評估並產出聯合評估報告,再由各國監管單位依該國程序做出最...
白宮攜科技巨頭推FHIR標準 掀全球智慧醫療互通革命
2025-08-05 / 資策會科法所
作者/資策會科技法律研究所跨域整合中心生醫衛政組黃毓瑩組長責任編輯:彭梓涵7月30日,美國聯邦醫療保險和補助服務中心(CMS)在白宮舉辦的「讓健康科技再次偉大(MakeHealthTechGreatAgain)」活動中,宣布攜手Amazon、Apple、Google、OpenAI、Anthropic、Oracle等科技巨頭,共同推動以「病人為中心」的智慧醫療生態系。同時CMS公布「互通性框架(In...
韓國食品藥物安全處發布全球首份《生成式人工智慧醫療器材之許可與審查指引》
2025-06-24 / 資策會科法所
背景與目的生成式人工智慧(GenerativeArtificialIntelligence,GenAI)已廣泛應用於醫療領域,例如影像判讀、治療建議、疾病預測與病歷撰寫等。然而,GenAI醫療器材具備持續學習新資料的能力,模型本身也會隨之動態變化,可能讓結果變得難以預測,且難以重複驗證。一般而言,傳統機器學習醫療器材須透過嚴謹的臨床試驗,以驗證特定適應症的安全性與有效性,若欲擴增適應症,仍須進行額...
藥品先進製造的里程碑,FDA發出第一個「先進製造技術認定」
2025-05-23 / 資策會科法所
背景近年來,國際政經局勢的變化促使全球製藥產業加速供應鏈重組。隨著醫藥技術的創新與突破,各國紛紛運用先進技術推動更具彈性與創新性的藥品生產模式,強化現有產品的製造能力,並積極推出新藥,以因應目前未被滿足的醫療需求。先進製造(AdvancedManufacturing)是新型或創新應用的醫療產品製造技術的統稱,這些技術可以提高藥品品質、解決藥品短缺問題並加快上市時間。包含連續製造(Continuou...
韓國對數位療法提供從監管到給付的積極政策
2024-11-18 / 資策會科法所
一、背景韓國政府於2019年宣布的生物健康產業創新戰略,決心大力投資生物健康;2022年時,更擬培育生物健康(Bio-Health)作為第二個半導體產業,認為必須積極主導全球市場,目標在於擴大醫療產業出口,進而躋身全球六大生物健康強國之列。在此前述背景下,基於巨量資料、人工智慧等資訊通訊科技(ICT)技術,為病人提供個人化醫療服務的浪潮興起,韓國政府將活用數位技術以創造新市場定位為關鍵政策領域,尤...
英國發布醫療器材國際認可框架之政策草案 以緩解脫歐後的醫材短缺隱憂
2024-11-05 / 資策會科法所
英國藥物及保健產品管理局(MedicinesandHealthcareProductsRegulatoryAgency,MHRA)於2024年5月21日公布醫療器材國際認可(Internationalrecognition)框架之意向聲明與政策草案,內容提到英國政府正在規劃未來將認可已於美國、加拿大、歐盟以及澳大利亞批准的醫療器材快速於境內上市。(編按:本草案於2024年10月時更新,將原先考慮將...
歐盟推動「新穎方法認證」:為藥品開發中的創新技術提供支持
2024-11-01 / 資策會科法所
隨著數位健康技術(DigitalHealthTechnologies,DHTs)及人工智慧等創新技術日新月異,各國政府相繼推出相關政策,以促進創新技術應用於新藥研發。美國FDA於2023年3月發布《數位健康技術應用於藥品及生物製劑開發之架構》,並鼓勵業者自願將DHT申請藥品開發工具(DrugDevelopmentTools,DDTs)認證(參見:美國FDA大力推動數位健康技術應用於藥品臨床試驗)。...
聚焦四大關鍵技術:合成生物學、基因和細胞治療、傳染病疫苗和治療、數位健康資料分析與利用
2024-10-24 / 資策會科法所
2023年10月31日,韓國科學技術資通訊部召開「國家策略技術特別委員會」第4屆會議,正式發布《人工智慧及先進生物策略藍圖》,引領韓國未來在全球科技與產業的競爭中處於領先地位。該藍圖強調了人工智慧和先進生物科技兩大核心領域,尤其在先進生物科技領域中,韓國政府提出四大關鍵目標,包括合成生物學的技術創新、基因與細胞療法的推進、應對傳染病的疫苗與治療,以及數位健康資料的有效應用。本文將聚焦於先進生物領域...


ILAP20250905.jpg)



















