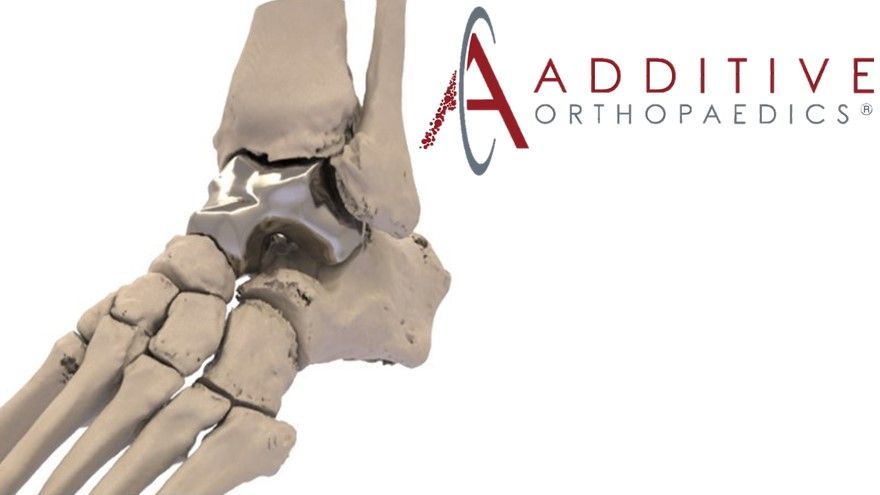
患者特定距骨植入物(Patient Specific Talus Spacer)是一種利用積層製造技術(additive manufacturing, AM)與3D列印技術製造的植入物,利用電腦斷層攝影(computed tomography, CT)影像數據,為每個患者量身打造符合解剖構造的植入物,植入物可使患者恢復運動並減輕疼痛,直到可能需要關節融合時為止。
此次批准是基於31例患者、32例距骨置換手術(其中一名患者的雙腳踝均進行了手術)的數據,手術後三年,患者平均疼痛指數從手術前的「中度至嚴重」減輕到術後的「輕度」,且踝關節的運動範圍也獲得改善。
而三年內,在32個病例中,有3例進行進一步的手術,最常見的不良事件是手術部位的疼痛和疤痕組織。
踝關節骨骼缺血性壞死通常是因為突然受傷(例如骨折或脫臼),導致骨骼供血不足,造成骨細胞失養而死亡。
當關節的骨骼損傷壞死時,會影響阻止骨骼之間磨擦的軟骨,引起關節炎,ANA發展到晚期時,可能會導致距骨部分或全部塌陷。目前的治療方式為關節融合術或膝下截肢。
人道用途器材免除是針對特殊之器材,若使用為治療或診斷疾病,且使用病患在美國每年小於8000例,則可申請HDE,以鼓勵廠商開發少數特殊病患使用的醫療器材。
FDA器械和放射衛生中心(CDRH)的骨科器械辦公室主任Raquel Peat表示,踝關節骨骼缺血性壞死是十分少見的退化性疾病,不僅會引起疼痛,更會導致踝關節運動受阻,嚴重的情況下甚至要截肢。此次批准可以減輕患者疼痛,還能保持關節活動範圍,並改善生活品質。
參考資料:https://www.fda.gov/news-events/press-announcements/fda-approves-first-world-first-its-kind-implant-treatment-rare-bone-disease-humanitarian-use-device
(編譯/李林璦)