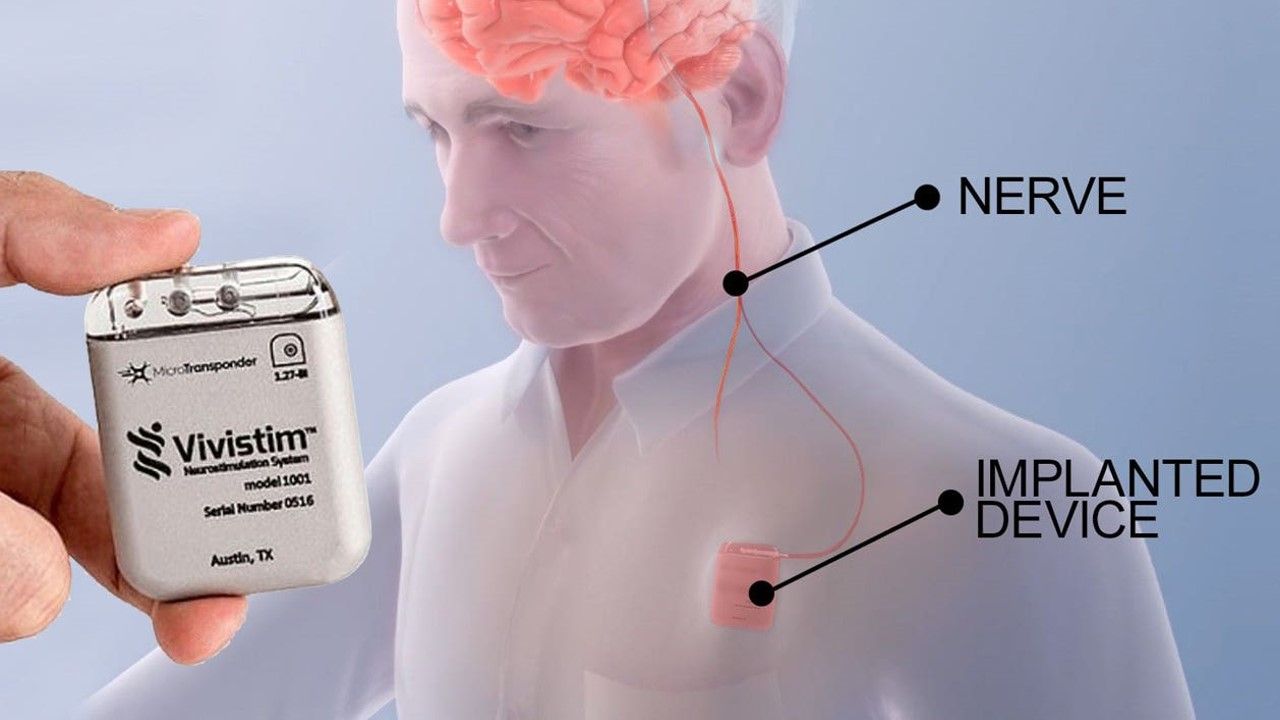
Vivistim系統是一種處方療法,治療中度至重度手臂和手移動困難的缺血性腦中風(ischemic stroke)患者。該系統需由醫護人員將可產生輕度電脈衝的植入式裝置,置入患者胸腔的皮膚下,透過電刺激迷走神經(vagus nerve)進行治療,可在家中或診所使用。
據FDA指出,連接到裝置的電線也被植入皮膚下,並將脈衝發送到放置在頸部左側的電極。Vivistim系統還包括筆記型電腦軟體和無線發射器,其僅供醫療保健提供者使用。
此次FDA批准基於在美國和英國108名中風患者的臨床試驗。該臨床試驗要求患者每天完成90分鐘,300至400次物理治療練習,每週3次,持續六週。
研究結果顯示,治療組接收了適量的迷走神經刺激(vagus nerve stimulation,VNS),對照組則僅接收非常低量的刺激。經過三個月的追蹤,研究人員發現,與對照組相比,接受Vivistim系統的中風患者,其手臂和手的移動,大為改善。
另外,使用Vivistim系統的副作用包括:說話困難、瘀血、跌倒、聲音嘶啞、疼痛、情緒低落、骨折、頭痛、皮疹等。
資料來源:https://www.drugs.com/news/fda-approves-first-nerve-stimulation-device-aid-stroke-recovery-100025.html?
(編譯/劉端雅)