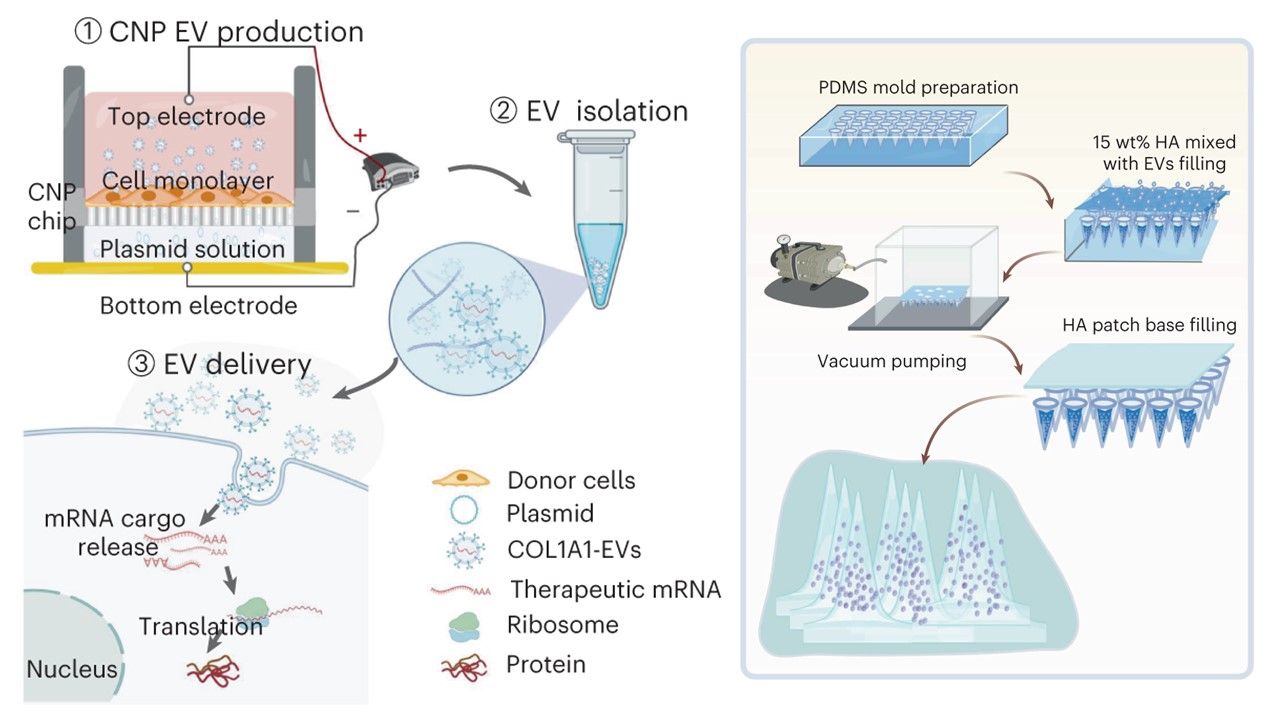
通訊作者之一、安德森癌症中心神經外科教授Betty Kim說:「我們開發出全新的mRNA傳輸方式,並在研究中使用它來啟動細胞製造膠原蛋白,它有潛力成為多種mRNA療法傳輸的解決方式。」
在此研究中,研究團隊使用EV裝載編碼膠原蛋白的COL1A1 mRNA,並利用皮膚貼片上的微針傳輸系統給藥,將mRNA傳遞到小鼠受到光照而老化的(photoaged)皮膚細胞,以模擬治療人類老化受損的皮膚。
結果顯示,單次注射此EV mRNA療法,在兩個月內改善了目標區域的膠原蛋白生成並減少了皺紋形成。
Kim表示,雖然啟動細胞製造膠原蛋白本身就是一項值得注意的成就,但更重要的是,此研究首次完成EV mRNA療法的概念驗證,為進一步評估EV作為mRNA傳輸系統的可行性打開了大門。
Kim也表示,將EV mRNA療法應用於臨床環境仍有很長的一段路,但這些早期研究結果很有希望。
現今熱門的mRNA療法希望透過將mRNA傳輸至體內,使之轉譯出功能性蛋白質來治療或預防疾病,不過,如何安全、有效、穩定地傳輸仍是其在臨床應用上面臨的最大障礙之一。
莫德納(Moderna)和BioNTech的新冠(COVID-19)疫苗是使用脂質奈米顆粒(LNP)進行傳遞,至於其他核酸藥物的傳輸系統目前主要都是病毒載體。這些傳輸系統每一種都有一定的局限性和挑戰,例如LNP面臨的挑戰,包括細胞毒性、體內生物分佈(biodistribution)差、免疫原性(immunogenicity)等。
細胞外囊泡是由細胞產生的微小結構,可在體內運輸生物分子和核酸。這些天然的囊泡經過修飾後可以攜帶mRNA,它們具有先天的生物相容性優勢,不會引發強烈的免疫反應,從而可以用於多次給藥。此外,這些細胞外囊泡也能讓攜帶的基因和蛋白質來得更大。
參考資料:https://www.news-medical.net/news/20230112/New-technique-could-overcome-the-delivery-hurdles-faced-by-promising-mRNA-therapies.aspx
論文:https://www.nature.com/articles/s41551-022-00989-w
(編譯/劉馨香)