百健/衛采阿茲海默症(AD)療法,即將在臺獲批!
近年,FDA批准3項Aβ抗體AD新藥,數十年來屢屢受挫,全球阿茲海默症新藥市場燃起曙光 ⁉
阿茲海默症新藥開發從Aβ靶點走到神經修復、抗發炎,臺灣6家公司以創新機制搶進臨床賽道!
此外,2024年全球阿茲海默症診斷新標準出爐,臺廠亦有7家創新早期篩檢新星,一同迎戰失智難題!
撰文:李林璦
採訪整理:李林璦、彭梓涵、吳培安
攝影:李林璦、彭梓涵、吳培安
視覺/美術設計:黃黛鵑
去年(2024)年11月,臺灣阿茲海默症療法迎來重量級消息!
台灣失智症協會理事長徐文俊,在失智症防治照護政策綱領成果發表會中向媒體透露,衛福部食藥署將審查通過臺灣首款延緩病程發展的阿茲海默症治療藥物。
雖然據本刊了解,食藥署表示目前仍在審查中,但仍意味著臺灣阿茲海默症患者將在不久後迎來從「症狀緩解」轉向「延緩病程發展」的創新療法。
目前,國際上獲美國食品藥物管理局(FDA)批准的阿茲海默症藥物,包含百健(Biogen)與衛采(Eisai)的Leqembi (lecanemab)以及禮來(Eli Lilly)的Kisunla (donanemab-azbt),均為靶向大腦中β型澱粉樣蛋白(Aβ)斑塊的單株抗體。
看似突破重圍的阿茲海默症新藥療法道路,一路荊棘滿佈,在2021年,FDA 20年來首次核准了阿茲海默症藥物――衛采/百健的Aduhelm (aducanumab),但過程充滿爭議,不僅諮詢委員會抗議FDA不顧專家質疑療效,更有3名專家忿而辭職,後續上市銷售也不順利,導致百健在2024年2月宣佈終止Aduhelm的開發與商業化。
更早於2019年時,中國海洋大學和上海綠谷製藥以海藻作為關鍵成分的「九期一」,獲中國國家藥品監督管理局(NMPA)核准上市,宣稱可用於輕度至中度阿茲海默症,改善患者認知功能。
九期一是中國第一款自主研發的阿茲海默症藥物,但該藥未發表臨床具體數據,數據亦未經同儕審查(Peer Review),受到國際多位專家質疑,中國本土也傳出各種質疑聲浪。
這些阿茲海默症的療法,究竟是解藥還是一場幻象?還是未解之謎
但可確定的是,近年的藥品批准為阿茲海默症療法領域帶來一線曙光,在經過數十年全球藥廠砸幾百億美金的投資研發,歷經無數次臨床試驗失敗的挫折,才好不容易獲得FDA認可,為各大藥廠打了一劑強心針,激勵了國內外廠商堅定持續開發創新阿茲海默症療法的決心。
「Aduhelm獲FDA批准雖然爭議性高,但這是一個阿茲海默症不再是不治之症的里程碑,也打通長久以來無新藥上市的障礙。」安立璽榮董事長陳泓愷說。
從「症狀治療」逐步邁向「延緩病程惡化」
各種的質疑與挫敗依然充斥,沒有阻礙阿茲海默症療法的開發……。
高齡化社會來臨,2023年全球有超過5千5百萬名阿茲海默症患者,到2050年預計將成長至1億3千9百萬人,20年翻倍成長,預計到2033年,阿茲海默症療法的市場規模將超過300億美元。
目前,獲得FDA批准的阿茲海默症療法分為兩大類,過去以症狀治療為主,透過乙醯膽鹼酯酶抑制劑、及非競爭性NMDA (N-methyl-D-aspartate)受體拮抗劑,針對神經傳導功能,改善認知功能狀態與精神行為,只能治標,無法改變阿茲海默症的病程惡化。
另一方面則是改善病程進展的DMT (Disease-Modifying Therapy)治療藥物,像是靶向Aβ斑塊的抗體藥物Aduhelm、Leqembi與Kisunla。
但是這三款抗體藥物在療效、副作用、適用患者限制上,都還不盡理想,普及性有待觀察。陳泓愷指出,像是Leqembi的臨床試驗結果顯示,治療早期阿茲海默症患者可減緩疾病惡化速度30%,約可延緩病程約6個月。
針對獲批療法療效不盡理想的原因,專家指出,阿茲海默症的發病機制十分複雜,尚無統一的定論,過去,全球各大藥廠是瞄準阿茲海默症最典型的病理特徵來開發藥物,包含細胞外Aβ堆積,以及細胞內神經元過磷酸化濤(Tau)蛋白纖維纏結。
美力齡生醫創辦人蘇益仁表示,抗體藥物只是到腦部清除細胞外沉積的Aβ,並沒有改變神經持續退化的問題,因此,應該朝更根源的機制來深入研究與開發療法。

美力齡生醫創辦人蘇益仁表示,抗體藥物只是到腦部清除細胞外沉積的Aβ,並沒有改變神經持續退化的問題,因此,應該朝更根源的機制來深入研究與開發療法。(攝影/李林璦)
Aβ假說備受挑戰 神經發炎、自噬功能障礙各家機制爭鳴
靶向Aβ堆積可治療阿茲海默症的假說,多年來也一直備受挑戰,最早是在2000年,Elan和惠氏(Wyeth)藥廠(已被輝瑞(Pfizer)併購)為首,找出可以穿過血腦屏障並減少小鼠體內Aβ斑塊的抗體 bapineuzumab,這是全球首個進入臨床試驗的Aβ抗體。
但2012年,bapineuzumab臨床三期實驗不如預期,病人認知度並未改善,宣告失敗。這次失敗,讓許多專家埋下對Aβ堆積假說產生疑慮。
同時,也促使產學界持續挖掘阿茲海默症的其他機制,陳泓愷指出,過去研究發現,Aβ在阿茲海默症發病前5~10年就已經沉積,但是有Aβ沉積卻沒發病,代表光有Aβ沉積不一定會導致疾病,可能還有Tau、神經發炎共同發生,才會讓阿茲海默症發病機率變高。
在2021年發表的《Nature Medicine》上也發現,雖然許多老年人腦中都有澱粉樣斑塊(Amyloid),但不一定會發展成阿茲海默症。
而發病與否的差異,可能是與腦內微膠細胞(Microglial Cells)過度活化引起的神經發炎,促使組成澱粉樣蛋白斑塊的Tau蛋白纏結在腦內擴散,使得患者的認知功能惡化、發展為阿茲海默症。
蘇益仁也分享,2022年,紐約大學精神科教授Ralph A. Nixon於《Nature Neuroscience》發表一篇論文,對阿茲海默症長期的Aβ觀點提出挑戰,研究發現,在Aβ斑塊於大腦沉積前,細胞內部就已經發生導致阿茲海默症的神經損傷。
研究指出,Aβ的累積是源於神經細胞自噬溶小體(autolysosome)功能障礙而導致,他表示,老化會使細胞內氧化壓力累積,造成蛋白質錯誤,通常細胞會透過細胞自噬(autophagy)來清除細胞內的錯誤蛋白,然而要是這個過程出了問題,錯誤摺疊的蛋白質與壓力在細胞內累積,在阿茲海默症中,細胞選擇了死亡。
「這顯示,Aβ不是導致阿茲海默症的原因而是結果,也解釋了為何這麼多進攻清除Aβ的療法公司會失敗。」蘇益仁說。
全球攻阿茲海默症新機制療法 127款藥物進臨床
如今,Aβ假說有了療法上市,幾乎可以說為這條機制路徑發展出的療法暫時劃上句點,接著,瞄準各種不同機制的療法,將是未來進攻阿茲海默症的關鍵。
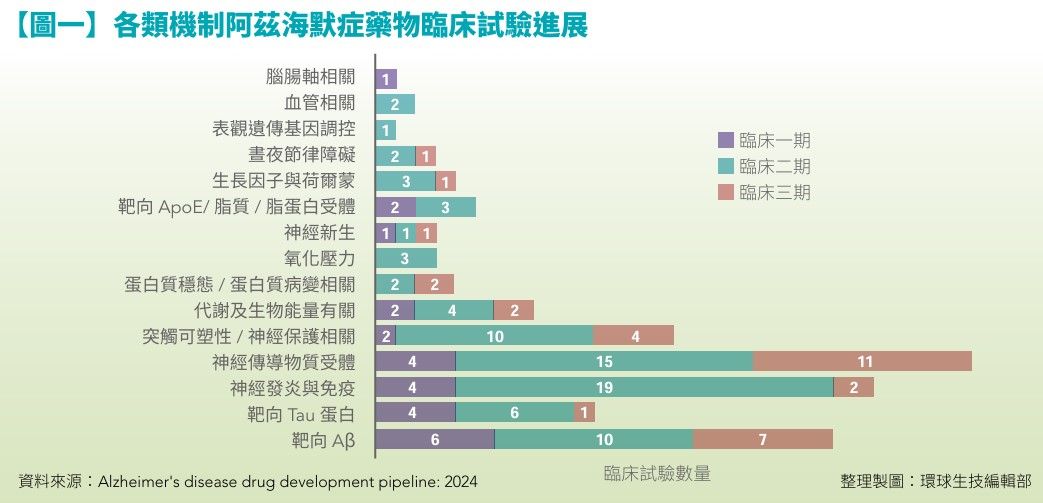
美國阿茲海默症協會(Alzheimer's Association)分析臨床試驗資料庫(ClinicalTrials.gov)的研究指出,2024年,共有127種阿茲海默症藥物進行164項臨床試驗。(見【圖一】)
其中有32款藥物進入臨床三期、81款藥物在臨床二期,25款藥物正在進行臨床一期;占比最高的大多是屬於改善病程進展的療法,共有96款藥物,佔76%,僅有15款藥物為增強認知功能症狀藥物,16款藥物屬於改善行為/神經精神症狀藥物,顯示,國際上新藥開發大多還是以改善病程進展為主。
而96款改善病程進展的藥物中,有28種靶向神經傳導物質受體、25種針對神經發炎、23種靶向Aβ堆積過程、15種與突觸可塑性/神經保護相關、11種靶向Tau蛋白相關途徑、8種與代謝及生物能量有關、5種靶向ApoE/脂質/脂蛋白受體、4種與蛋白質穩態/蛋白質病變相關、3種與氧化壓力/神經新生/晝夜節律障礙有關、2種與血管有關、1種與腦腸軸相關。
此外,比爾蓋茲資助1,000萬元、阿茲海默症協會也以「撥雲計畫」(Part the Clouds)募資2,000萬美元,目標是探索阿茲海默症等神經退化性疾病的創新機轉治療方式,包括腦細胞如何使用能量、腦細胞如何清除廢物避免蛋白質堆積,以及大腦如何維持血液供應等。
中央研究院神經賦活團隊專案研究員張敬邦博士表示,在CTAD (Clinical Trials on Alzheimer's Disease)研討會中,專家普遍認為發展靶向Aβ、Tau蛋白療法可能已難以滿足臨床需求,並鼓勵產學界積極探索其他作用機制的新穎治療策略。
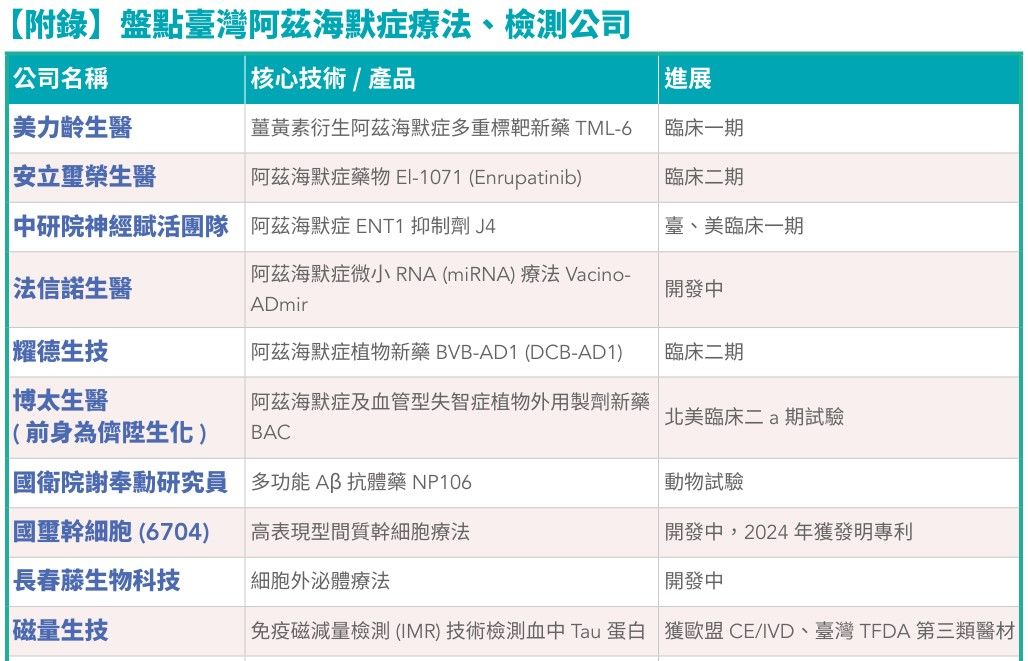
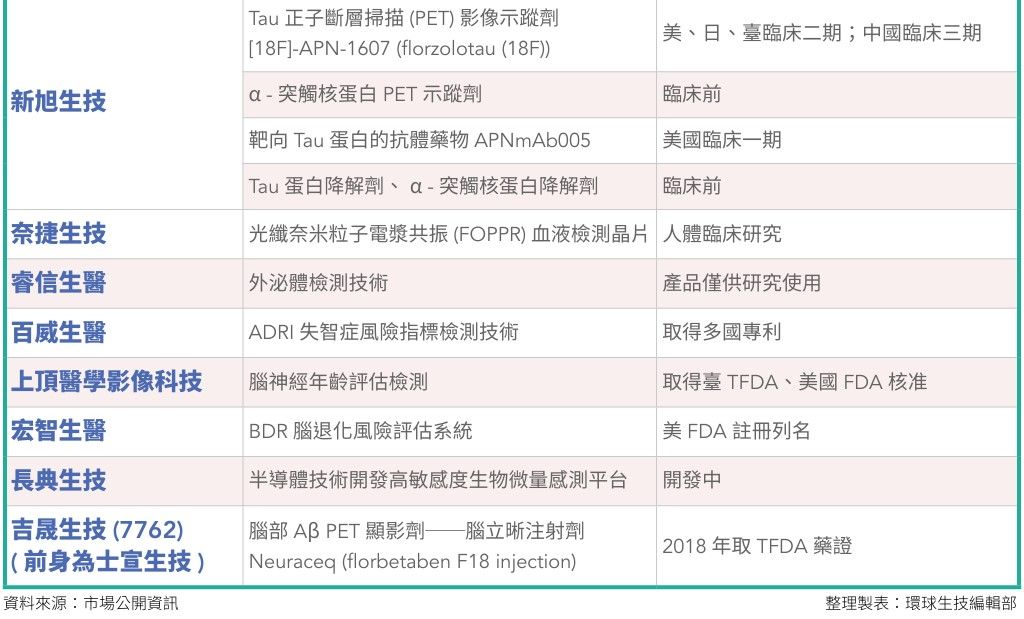
國際上,阿茲海默症新藥開發已經朝向從不同機轉著手開發療法。而臺灣,也有6家已走到臨床試驗的公司正在蓄勢待發。(詳見後文介紹)
診斷新標準出爐!病理證據成關鍵
新藥開發成功的關鍵,不僅在於藥物本身的設計,如何找出適合治療的患者族群以及評估治療效果的臨床終點都可能影響能否取得藥證。
奈捷生技董事長鍾尊智表示,「未來,藥物開發將更趨向多靶點療法及多重生物標記檢測(Multi-biomarker Testing),並透過精準醫療來選擇最適合的患者族群。」
實際上,2024年6月《阿茲海默暨失智症》(Alzheimer's & Dementia)期刊公布了阿茲海默症的診斷與分期標準最新版,除了臨床失智症嚴重度評估表(CDR)及簡易心智量表(MMSE)評估外,還須提出以檢驗或腦影像檢查結果的「病理證據」,而非僅依據臨床症狀來做診斷。
像是百健與衛采的Leqembi、禮來的Kisunla都僅能提供給輕度認知功能障礙(MCI)、輕度阿茲海默症患者使用,但在給藥前需進行腦脊髓液檢查、類澱粉正子攝影等來確認Aβ的堆積,並經基因檢測確認是否帶有特定的載脂蛋白Eε4(ApoEε4)基因,因為攜帶該基因的患者較容易產生副作用而需特別注意。
隨著藥物市場對伴隨式檢測需求的日益增加,檢測技術廠商也與藥廠共振,開始探尋更多與阿茲海默症病理證據檢測相關的合作,形成一個巨大生態系。
像是衛采在2024年3月,注資1,500萬美元給C2N Diagnostics,期望將單次高達1,200美元的檢測「PrecivityAD」透過與其他診斷平台合作,增加其普及性。
該檢測是C2N與禮來共同開發出應用在血液檢測的質譜技術,目前已獲得美國FDA突破性設備資格(BTD),可透過分析患者血中Aβ40、Aβ42、p-tau217來區分出早期患者與正常人。
禮來十分積極佈局檢測市場,2022年3月,禮來以1,100萬美元獲得Quanterix技術授權,開發p-tau217抗體試劑的非獨家全球許可,這些試劑將用於研究、臨床試驗及未來診斷及追蹤市場。
Quanterix也是美國知名阿茲海默症血檢公司,其Simoa宣稱比傳統的ELISA靈敏1,000倍,可檢測Aβ40、Aβ42、p-tau181、p-tau217、p-tau231、NfL、GFAP等,並以獲得FDA授予突破性設備資格。
同時,禮來還與羅氏(Roche Diagnostics)合作開發不同平台的試劑,持續拓展阿茲海默症檢測量能,來增加藥物的使用量。
在阿茲海默症血檢領域中,臺灣也有磁量生技(MagQu)以「Aβ40、Aβ42、Tau蛋白免疫磁減量檢測(IMR)試劑」獲得臺灣第三類醫材認證;奈捷生技運用光纖粒子電漿共振(FOPPR)技術開發出阿茲海默症血液檢測晶片;由臺大應用力學研究所胡文聰教授技轉創辦的睿信生醫開發血中外泌體檢測;百威生醫開發「ADRI失智症風險指標檢測技術」測量血中氧化態異常蛋白(GAPDH)的含量來預估阿茲海默症;還有借重半導體技術開發生物微量感測平台及其應用的長典生技,也在默默開發高敏感度的AD早期精準檢測。
但是,至今FDA還未正式批准任何阿茲海默症的血液檢測。
血檢落地困境多! 待全球統一標準
奈捷生技國際行銷部總監黃淑莉指出,血液生物標記物(如 p-tau217、p-tau181、Aβ42/40)在近年已廣泛應用於多項國際臨床研究中,顯示其在阿茲海默症早期偵測具高度潛力。目前不同檢測平台正持續優化,全球也正建立共識標準,未來有望訂立明確的Cut-Off值,讓血檢實際應用臨床診斷與決策。
目前,美國阿茲海默症協會正主導推動「全球生物標記標準化聯盟(Global Biomarker Standardization Consortium, GBSC)」,攜手全球科學家、監管機構與企業,建立包括 p-tau217、p-tau181、Aβ42/40 在內的血液生物標記物標準。
此外,美國阿茲海默症協會也與美國國家老年病研究所(NIA)及國際阿茲海默症工作小組(IWG)合作,推動NIA-AA診斷標準,逐步將血液生物標記物納入阿茲海默症的診斷評估架構中。
鍾尊智表示,隨著歐美市場對血液檢測技術的關注與接受度持續提升,也正穩步進行標準化與臨床流程整合。未來在技術一致性與規範逐步建立後,有望使不同血液檢測技術(如 FOPPR、Simoa、LC-MS)之間具備數據可比性與一致性,加速血液生物標記物納入臨床決策流程,擴大其應用範圍。
此外,鍾尊智指出,目前已有部分國家著手將血液生物標記物檢測納入健保體系。加上臨床實證累積與標準化進程的推動,期望有更多國家將此類檢測納入醫療給付體系,提升血檢的可近性與普及率。

奈捷生技董事長鍾尊智表示,未來在技術一致性與規範逐步建立後,有望使不同的血液檢測技術之間具備數據可比性與一致性,加速納入臨床決策流程。(攝影/吳培安)
臺灣阿茲海默症類澱粉蛋白PET 近20年前已起步
目前,阿茲海默症的病理特徵診斷,主要是以大腦的磁振造影(MRI)、類澱粉蛋白及Tau蛋白的正子電腦斷層攝影(PET)、腦脊髓液的類澱粉蛋白及Tau蛋白的檢驗來做為診斷依據之一。
國內失智症權威、臺灣失智症協會理事長、長庚失智症中心主任徐文俊是臺灣最早期進行類澱粉攝影的醫師,他指出,在病理檢測出現以前,阿茲海默症的診斷是仰賴1984年由美國神經疾病與腦中風機構(NINDS)與歐洲ADRDA兩個研究機構研擬的標準,主要是觀察記憶與其他認知功能是否慢慢發生問題且逐漸惡化,但經常確診時,已經是阿茲海默症發病嚴重的時候,無法更早期診斷。
「但類澱粉蛋白攝影的出現,讓阿茲海默症有了真正的病理診斷檢測,就像確診腫瘤時,醫師需要切片確認腫瘤是惡性才會診斷為癌症。」他說。
徐文俊表示,血檢相對侵入性小,也比較便宜,目前臨床上會希望使用血檢篩出高風險者,再搭配後續類澱粉攝影進行確診。
臺灣發展阿茲海默症類澱粉蛋白攝影十分早期,2007年起,長庚大學與林口長庚醫院迴旋加速器設施共同開發多種PET造影放射藥物,並透過國際合作研發檢測阿茲海默症乙型類澱粉蛋白斑塊的氟-18-AV-138、氟-18-AV-45 (Florbetapir)。
這個時間點比2012年FDA批准首款阿茲海默症病理檢測還要早,首款阿茲海默症病理檢測是賓州大學(UPenn)和Avid Radiopharmaceuticals(現已被禮來(Eli Lilly)收購)合作研發的AV-45 (Amyvid),其使用PET來偵測有記憶問題患者大腦中澱粉斑塊。
臺灣也有首家經衛福部及原能會認證的核子醫學藥廠吉晟生技(原名士宣生技)(7762),開發用於腦部PET顯影劑腦立晰注射劑Neuraceq (florbetaben F18 injection),於2018年12月取得TFDA藥品許可證,可估計大腦中Aβ神經炎斑塊的密度,協助阿茲海默症診斷。
此外,尚有3家公司也在腦部造影領域中開發新技術,包括新旭生技、上頂醫學影像科技、仁寶(2324)集團子公司宏智生醫。(詳見後文)
>>本文刊登於《環球生技月刊》Vol. 125









