一、背景
南韓政府認為鑑於全球人口老齡化趨勢和全球對良好健康照護需求的成長,生物健康(biohealth)產業的需求快速成長,為一個有前途的新興產業。此外,生物健康之重要性還涉及公共衛生安全的考量,包括保護人們生命、健康和安全所需的疫苗和其他治療方法。南韓的生物健康產業多年來取得了顯著成就,包括發展了世界第二大生物醫藥生產能力,但全球生物健康市場廣泛,南韓認為該國國內仍有巨大的成長空間生物健康產業。為了推動生物健康產業成長,南韓政府認為需要針對阻礙產業成長的不合理、不明確之監管進行改善,以減少創新產品(服務)市場受到限制。
據此,南韓衛生福利部於2023年3月的第三次監管創新戰略會議上宣布了《生物健康新產業監管創新方案》(바이오헬스 신산업 규제혁신 방안),以尋求生物健康監管的創新,為南韓成為「數位與生物健康之全球中心」(디지털·바이오헬스 글로벌 중심국가)奠定基礎。該方案包含三大推動原則:
1. 推動兼顧生命安全與產業創新的監管機制優化措施
2.推動六大關鍵技術(包含➊創新醫療器材、➋創新/必備藥物、➌數位醫療、➍先進再生醫療+先進生物製劑、➎基因檢測、➏腦機介面)與基礎設施相關監管措施優化
3.轉型為「先允許,後監管」方式,藉以縮小監管範圍,例如由僅允許列管事項方式,轉換為僅禁止列管事項方式等
二、「上市許可–納保評估–藥價協商」三軌並行制
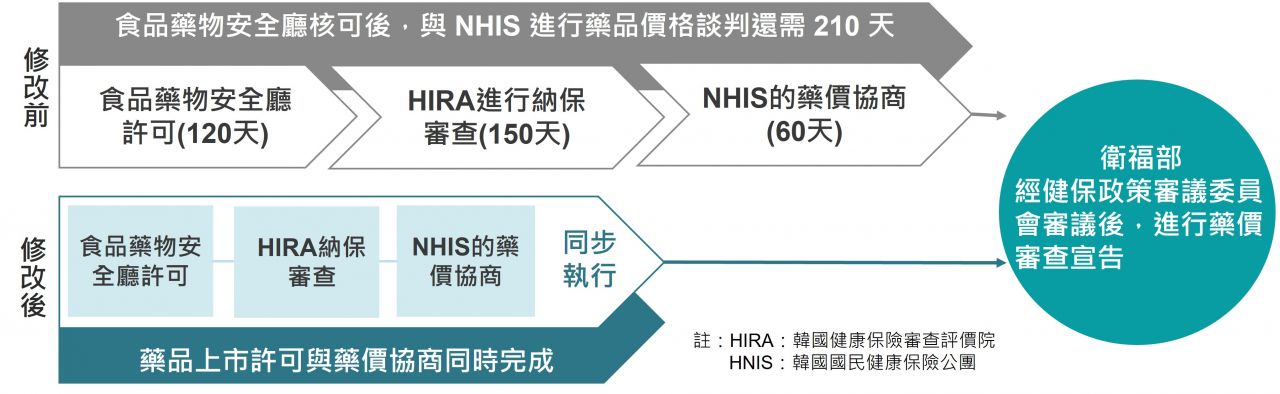
儘管目前南韓已有推動改善制度以確保新藥的快速近用性(accessibility),例如2014年9月起推動的「上市許可-健保評估聯動制度」(허가-평가연계제도)[1],允許符合特定條件的新藥,即使尚未獲得食品藥物安全廳的最終許可,只要安全性和有效性評估完成,便可申請納入健康保險;以及和2023年1月起對威脅生命之重症疾病的高價治療藥物,實行「健保評估-藥價協商並行制度」(급여평가-약가협상 병행제도)。南韓社會仍然存在著「應將重症疾病新藥快速納入健保給付」之要求,目前藥品獲得上市許可後,從納入健保給付的評估到完成藥價協商,仍需210天。因此,《生物健康新產業監管創新方案》中,對於沒有替代藥物但改善效果顯著的癌症和罕見疾病治療藥物,推動「產品上市許可–健保給付評估–藥價協商」三軌並行的試辦計畫,由食品藥物安全廳、南韓健康保險審查評價院(HIRA)、南韓國民健康保險公團(NHIS)聯合執行,藉以確保病人獲得創新治療新藥之可近性及減輕經濟負擔,參見下圖。該試辦計畫從2023年1月開始實行,擬將納入健保給付的評估到完成藥價協商的210天縮短到150天。
圖1 南韓改善新藥快速收載制度
資料來源:資策會科法所整理自南韓《生物健康新產業監管創新方案》
三、進展現況
欲參加試辦計畫的候選藥物應提交與許可相關的資料,包括南韓國內許可申請預定日期、功效效果、其他國家許可情況及許可事項、與南韓國內的一致性與否、適應症中的疾病嚴重程度及預期壽命、生存率、現有治療方法等內容。此外,還需要提交臨床效用證據、預計患者數量、A8國家(即與韓國簽訂了社會保障協定的八個主要國家,包括美國、日本、德國、法國、澳大利亞、加拿大、英國和比利時;這些國家的國民在韓國居住和工作時,可以根據協定享有韓國的健康保險服務,而不需要支付額外的保險費用)上市狀況及價格、其他國家福利評估結果等成本效益資料。2023年啟動的第一次試辦計畫已核可了兩種兒科罕見疾病治療藥物:神經母細胞瘤(high risk neuroblastoma)的免疫療法新藥Qarziba®以及治療急性髓性白血病新藥的VYXEOS®。然而,在2024年第八次藥品報銷評估委員會(약평위)審議結果中Qarziba®不再獲得健保給付資格;VYXEOS®則被認為適合健保給付。當天藥物評價委員會(약평위)也修改了「新藥等協商對象藥物的詳細評價標準」(신약 등 협상대상 약제의 세부평가기준),這是為了擴大風險分擔制的適用範圍,使其涵蓋用於重大疾病負擔的重症難治性疾病藥物,並針對追加申報金額低於150億韓元之風險分擔藥物的補貼擴展流程予以簡化,以提高病人的近用性;此外,本訂修標準還具體化了遞增成本效果比值(incremental cost-effectiveness ratio, ICER)臨界值評估所需的創新性意義,並明確了基於療效之還款型風險分擔適用藥物的臨床成果評估流程,從而為反映新藥的適當價值提供了標準。可見南韓已從第一年的試辦計畫結果進行滾動式修正,也開始於2024年6月啟動第二次試辦計畫需求調查,後續動態仍很值得關注。
[1] https://www.mohw.go.kr/board.es?mid=a10501010400&bid=0003&tag=&act=view&list_no=304707
(撰文/資策會科技法律研究所 黃毓瑩組長)









