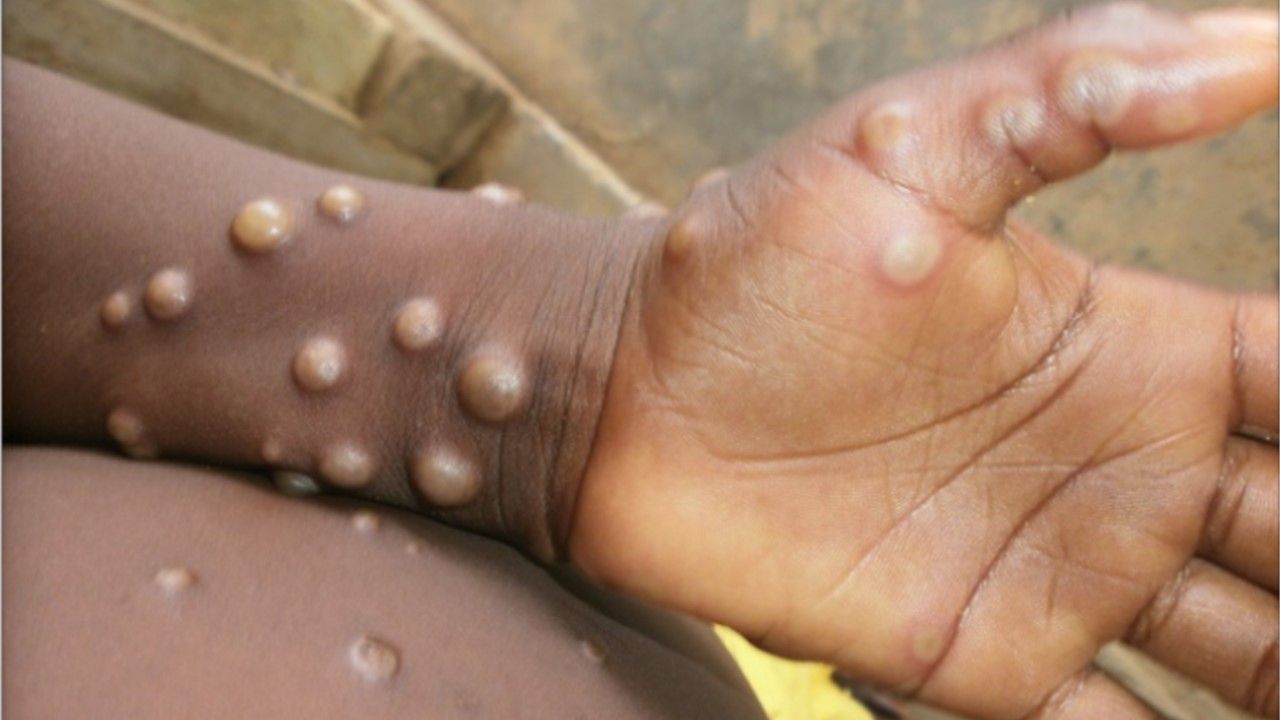
日前(9),美國國家衛生研究院(NIH)旗下國家過敏和傳染病研究所(NIAID)資助的愛滋病臨床試驗團隊(AIDS clinical trial group, ACTG),啟動了一項猴痘臨床3期試驗,運用先前批准用於治療天花病毒的抗病毒藥物tecovirimat(也稱為TPOXX)來治療猴痘,預計將招募530名成人和兒童猴痘感染者。
此次tecovirimat的3期臨床試驗由紐約市威爾康奈爾醫學院(Weill Cornell Medicine)教授Timothy Wilkin主導,不論年齡、只要患有猴痘成人和兒童都有資格參加試驗,共招募530名受試者,以2:1的比例隨機分配至tecovirimat治療組或安慰劑組,不過,患有猴痘重症者以及高風險人群,包含:具有免疫缺陷、發炎性皮膚病、孕婦和兒童將直接被納入tecovirimat治療組。
受試者將口服tecovirimat膠囊14天,至少追蹤8週,且每天需填寫症狀紀錄,在家中遠距或至診所進行皮膚檢查,並提供血液和其他體液樣本,包含猴痘病灶中的液體。
臨床試驗指標為病變結痂或剝落癒合的速度、疼痛評分、發展為重症的速度、體內猴痘病毒的數量及安全性等等。這項研究也將提供有關tecovirimat 在兒童和孕婦中的最佳劑量和安全性的關鍵數據。
NIAID還與剛果民主共和國國家生物醫學研究所(INRB)合作,在該國啟動一項針對罹患猴痘的成人和兒童的單獨臨床試驗,更詳細的臨床試驗資訊將在後續公告。
Tecovirimat由紐約製藥公司SIGA Technologies Inc與美國衛生及公共服務部(HHS)旗下的生物醫學高級研究與發展局(BARDA)共同開發,透過靶向痘病毒科(Poxviridae)、正痘病毒屬(Orthopoxvirus)中天花病毒與猴痘病毒上的蛋白質VP37來阻止病毒在體內傳播。
目前,美國臨床醫師可以透過恩慈療法使用tecovirimat治療猴痘患者。
Tecovirimat是於2018年7月13日獲美國食品藥物管理局(FDA)批准用於治療天花,也是第一個治療天花的藥物;歐盟於2022年1月10日批准tecovirimat可用於治療天花、猴痘、牛痘以及牛痘感染引起的併發症,英國則於同年7月8日批准。
NIAID主任Anthony S. Fauci表示,猴痘是一種會持續數週、極其痛苦的感染疾病,目前缺乏療效數據幫助我們了解tecovirimat在減輕猴痘疼痛症狀和預防重症方面的效果,因此,本次進行的臨床試驗目的便是回答這些重要問題。
2022年5月,全球首次爆發人類猴痘病毒疫情,促使世界衛生組織(WHO)和HHS在今年7月宣布猴痘疫情列為「國際關注公共衛生緊急事件」(PHEIC)。
從2022年1月1日到2022年9月7日,世界衛生組織已在102個國家/地區收到52,996例病例和18例死亡的案例報告。美國疾病控制和預防中心(CDC)則收到21,504例病例報告。
參考資料:https://www.nih.gov/news-events/news-releases/us-clinical-trial-evaluating-antiviral-monkeypox-begins
(編譯/李林璦)


- 讀者服務電話:(02)2726-1065時間:週一 ~ 週五 9:00 ~ 18:00
- 服務信箱:[email protected]
- 地址:110臺北市信義區信義路六段29號2樓之一, Taiwan
- Copyright© 2024 環球生技多媒體股份有限公司. All rights reserved.本文內容受著作權法保護,如有引用請註明出處。授權申請。隱私宣告Privacy。會員條款User Terms。
為了提供您最佳的服務,本網站會在您的電腦中放置並取用我們的 Cookie,若您不願接受 Cookie 的寫入,您可在您使用的瀏覽器功能項中
設定隱私權等級為高,即可拒絕 Cookie 的寫入,但可能會導至網站某些功能無法正常執行 。