北極星藥業表示,將繼續完成臨床試驗報告,接下來會運用FDA今年2月授予的快速審查資格(Fast Track),積極加快申請藥證的時程。
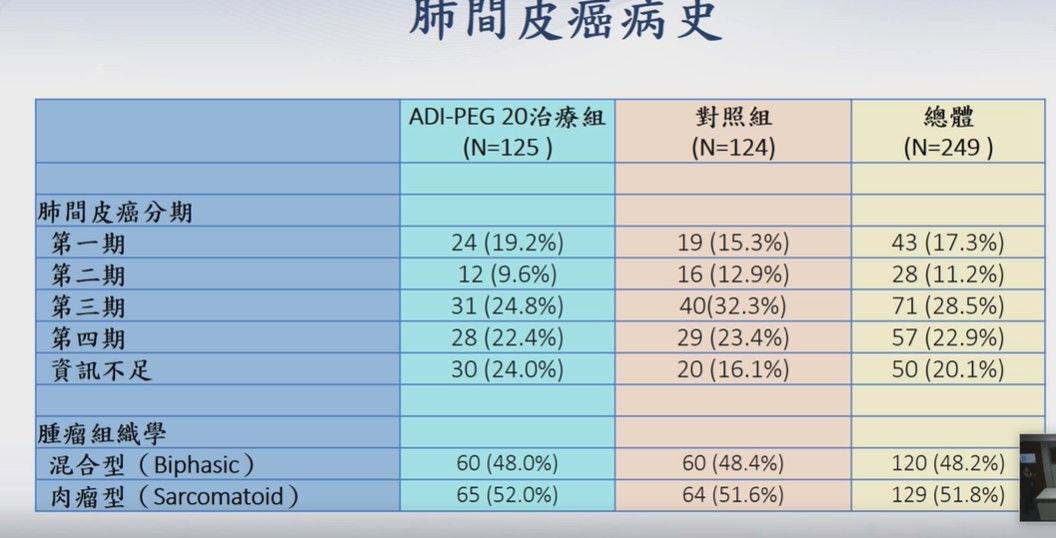
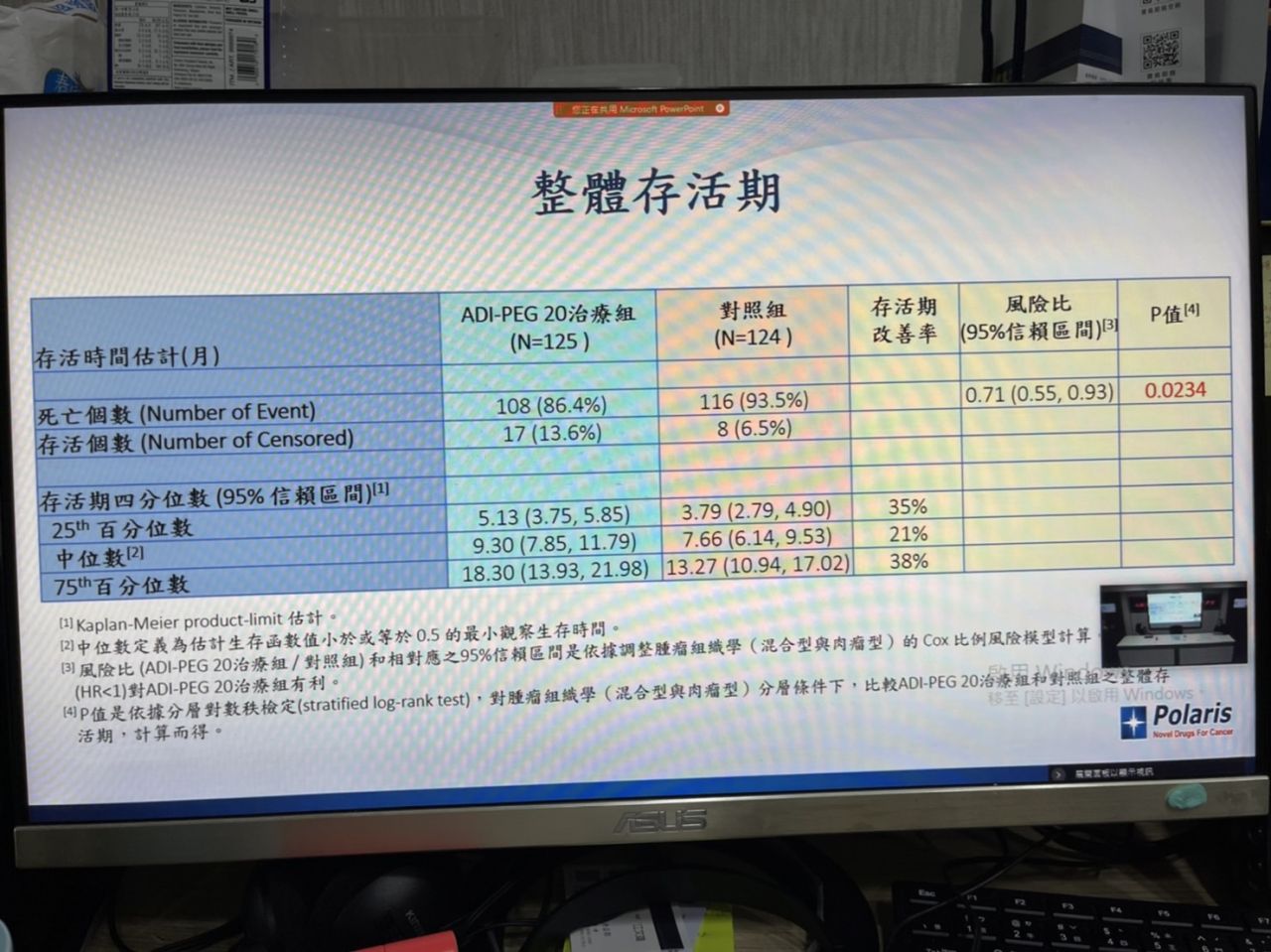
該試驗共收案249位病人,其中ADI-PEG 20試驗組125人、對照組124人。期末分析249位受試者的結果顯示,主要療效指標方面,試驗組ADI-PEG 20聯合Cisplatin和Pemetrexed療法的整體存活期(OS)中位數9.3個月,與對照組Cisplatin和Pemetrexed合併治療的整體存活期中位數7.66個月對比,改善幅度達21.4%。
其中,試驗組在第25百分位數OS改善幅度高達35.4%、第75百分位數OS改善幅度更高達38%,試驗組存活人數更達對照組兩倍之多(提升109%),已達到統計學上顯著意義(p=0.0234)。不過,數據也顯示,在第四期肺間皮癌患者的試驗組(22.4%)和對照組(23.4%)無明顯差異。
次要評估指標無惡化存活期(PFS)方面,在第25百分位數PFS,試驗組為3.94個月、對照組為2.6個月;第50百分位數PFS,試驗組為6.11個月、對照組為5.59個月;第75百分位數PFS,試驗組為9.3個月、對照組為7.59個月,並且也達到統計學上顯著意義(p=0.0159)。
在安全性評估方面,ADI-PEG 20試驗組在開始治療後的不良事件比例為98.4%,對照組99.2%;治療期間發生嚴重不良反應,與ADI-PEG 20相關為8.8%,安慰劑相關為9.7%。試驗組和對照組的不良反應率並無明顯差別,顯示ADI-PEG20極佳的安全性。
北極星藥業表示,ADI-PEG 20在癌症治療上,有別於目前大多數人使用的化療、標靶、免疫療法,而是採用代謝療法搭配聯合用藥的方式來進行治療。
北極星藥業表示,後續肝癌三期試驗、軟組織瘤三期試驗、腦瘤2/3期試驗將持續進行,同時也會開展相關代謝疾病適應症,如重度脂肪肝加上糖尿病的相關臨床試驗。









