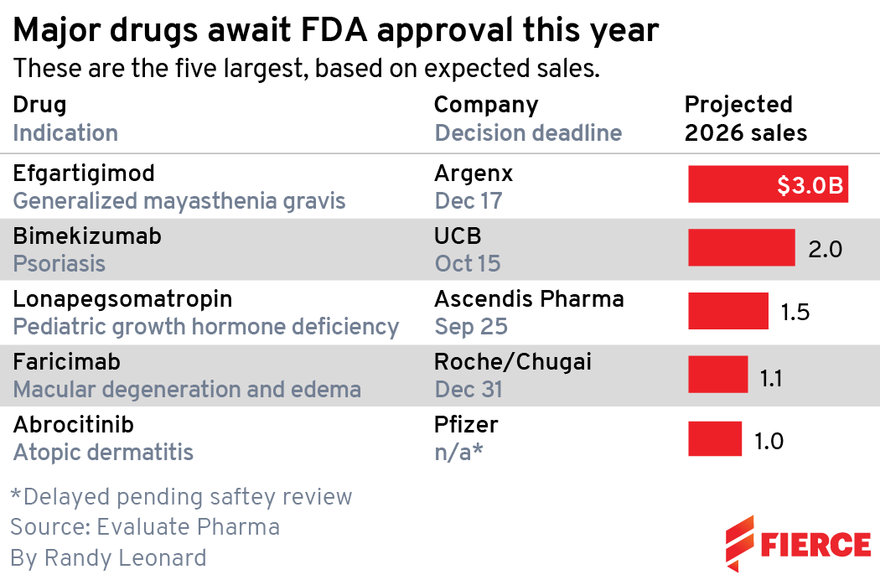
近(7)日,市調公司Evaluate Vantage統計出今年下半年,美國食品藥物管理局(FDA)有望批准的5大重量級藥物,以及其2026年的估計銷售額,其中銷售額估值排名榜首的為荷蘭藥廠Argenx開發的重症肌無力藥物efgartigimod,預計達30億美元。其他上榜藥物還包括:UCB乾癬藥bimekizumab、羅氏(Roche)黃斑部病變藥物faricimab、輝瑞(Pfizer)異位性皮膚炎藥abrocitinib等。
Efgartigimod
由Argenx開發的自體免疫疾病——重症肌無力藥物efgartigimod,FDA最晚將在12月17日作出審批決定。
一但獲批,efgartigimod將成為第一項抗新生兒Fc受體(FcRn)藥物。該類藥物被視為自體免疫疾病中,革命性的新希望;藉由削減FcRn的作用,可讓患者體內免疫球蛋白G (IgG)濃度降低、減緩疾病。
(編按:FcRn存在於新生兒胎盤中,負責把母親的IgG輸送給胚胎,新生兒時期過後,FcRn的存在則能讓人體內的IgG維持在較高的濃度。)
根據Evaluate估計,efgartigimod到2026年的銷售額可達30億美元;SVB Leerink更估計其2030年美國銷售額,可能高達250億美元。Argenx也估計,比起包括:Momenta Pharmaceuticals、UCB和阿斯特捷利康(AZ)旗下Alexion Pharmaceuticals等開發抗FcRn藥物競爭對手,他們仍可領先三年之多。
Bimekizumab
由UCB研發的乾癬藥物bimekizumab,由於在今年發表結果的臨床三期試驗中,展現比嬌生(J&J)Stelara和諾華(Novartis) Cosentyx兩項重量級藥物更佳的藥效,因此備受看好。Evaluate估計,其到2026年的銷售額,預計達20億美元。
Bimekizumab為特異性中和IL-17A和IL-17F的單株抗體。IL-17A和IL-17F是驅動發炎反應的兩種關鍵細胞因子,也會與其他促發炎細胞因子協同作用,放大發炎反應。
今年2月發表在《The Lancet》的臨床三期試驗「BE VIVID」顯示,85%服用bimekizumab的患者,在第16週時乾癬面積暨嚴重度指數下降至少90% (PASI 90),並有59%的患者完全緩解(PASI 100);同時,嬌生的Stelara只幫助到一半的患者達到PASI 90、21%的患者完全緩解。
不過外媒認為,bimekizumab上市後仍將面臨激烈的市場競爭,包括艾伯維(AbbVie)的Skyrizi和Humira、禮來(Eli Lilly)的Taltz和安進(Amgen)的Otezla,都可能以龐大的營銷預算擊敗bimekizumab。
Lonapegsomatropin-tcgd
丹麥藥廠Ascendis Pharma的長效生長激素Skytrofa (lonapegsomatropin-tcgd),已在8月底取得批准,該藥預計到2026年銷售額將達到15億美元。
其適應症為兒童生長激素缺乏症(growth hormone deficiency,GHD),可在體內釋放生長激素,但與目前每天需皮下注射的生長激素產品不同的是,可將給藥頻率延長為每週一次。
Faricimab
羅氏的老年黃斑部病變(AMD)藥物faricimab,為一項VEGFxAng2雙特異性抗體。
該藥物目前最大的競爭對手,為再生元(Regenron)和拜耳(Bayer)的Eylea (aflibercept),該藥物與faricimab皆為玻璃體內注射的劑型。羅氏已在4項三期試驗中發現,針對faricimab的效果並不比Eylea 差,約一半的患者能夠使用faricimab時藥效可持續4個月,而使用Eylea則是2個月。
不過這可能仍不足以讓羅氏趕上領先的再生元,目前預估faricimab到2026年的銷售額為11億美元,遠低於Eylea目前的銷售額(2020年Eylea銷售額為83.6億美元)。
Abrocitinib
輝瑞鎖定異位性皮膚炎治療的abrocitinib,為一項JAK1抑制劑。Evaluate估計其到2026年,銷售額可能達到10億美元,不過這只是輝瑞所估計該藥潛在最高收入的三分之一。
今年8月底,輝瑞宣布abrocitinib的臨床3b期數據顯示,該藥在服用後第2周和第4周時,對於清除患者的瘙癢和濕疹症狀,效果勝過賽諾菲(Sanofi)和再生元的Dupixent。
不過,由於輝瑞另一項JAK抑制劑Xeljanz剛結束FDA長達數個月的安全性調查,且除了Xeljanz外,另兩項JAK抑制劑——艾伯維的Rinvoq和禮來的Olumiant,也在9月1日被FDA要求提供新的心臟風險和癌症安全性警告,因此分析師認為,接下來abrocitinib的安全性可能也難逃FDA質疑。
過去,FDA曾因安全性考量拒批其他JAK抑製劑,包括吉利德(Gilead)用於治療類風濕性關節炎的filgotinib。不過輝瑞和FDA都未曾表示這是否會阻礙abrocitinib的批准。
參考資料:https://www.fiercepharma.com/pharma/from-pfizer-to-argenx-a-look-at-potential-blockbusters-awaiting-fda-decisions-to-close-out
(編譯/巫芝岳)









