美國時間22日,約翰霍普金斯醫院(Johns Hopkins)研究團隊,從原生動物研究中得到啟發,進而找出人類細胞中兩種與表觀遺傳學修飾相關的酵素及甲基化標靶。缺乏這兩種酵素或是發生突變,可能與腦瘤、血癌或是罕見遺傳性神經退化疾病——Kleefstra 症候群有關。這項研究發表在今年11月的《Epigenetics & Chromatin》。
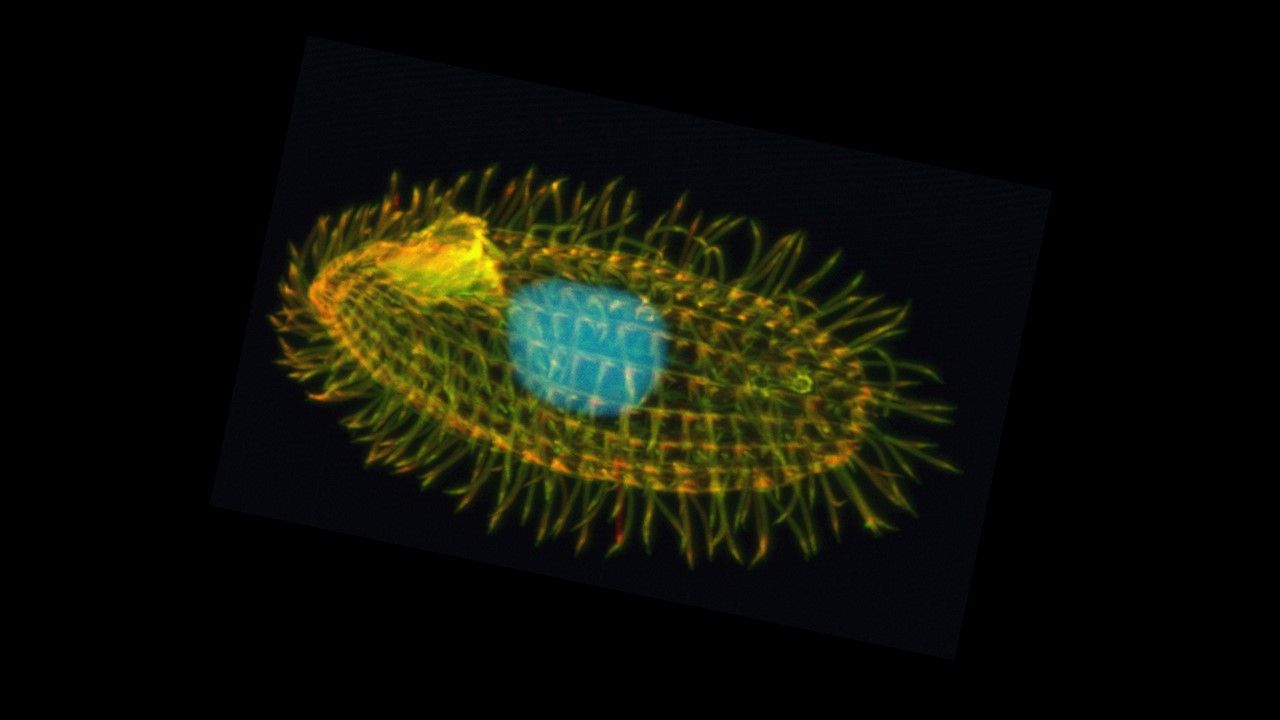
帶領此研究的通訊作者、約翰霍普金斯大學醫學院藥理及分子科學副教授Sean D. Taverna,已經研究這項主題十幾年。起先他在研究四膜蟲(Tetrahymena thermophila)這種水生原生動物時,發現了一種過往未知的甲基化訊號,能讓四膜蟲這種單細胞生物,在關閉的基因上添加標記。
Taverna表示,這種標記存在於組蛋白(histone proteins)上。組蛋白是一種如同線軸一般,被DNA長鏈緊緊纏繞的蛋白質構造,它也在關閉基因、避免DNA受損中扮演重要角色。倘若四膜蟲失去在組蛋白上的H3K23位置添加這種標記的甲基化能力,牠的DNA就會受損,細胞生長也會不良。
在一項2016年的後續研究中,Taverna團隊發現這種H3K23位置的標記,在四膜蟲和哺乳類動物體內呈現保守(conserved),不過控制這些化學標記的機制,在不同物種中卻有所差異。他們認為,若是沒有掌握這些甲基化機制的關鍵酵素,就無法研究H3K23在人體生物學和疾病中的角色。
在這項最新的研究中,Taverna和博士後David Vinson等人組成的團隊,以及和約翰霍普金斯金梅爾癌症中心(Johns Hopkins Kimmel Cancer Center)癌症學及病理學教授Srinivasan Yegnasubramanian合作,從許多具備甲基化標記寫入能力的酵素中,篩選出兩種典型的組蛋白H3K9甲基轉移酶——EHMT1/GLP和EHMT2/G9a。
研究團隊表示,這兩種酵素會將化學標記添加到組蛋白的H3K23位置。在甲基化活性上,這兩種酵素都能進行單甲基化(mono-methylate)和雙甲基化(di-methylate),但只有EHMT1/GLP能夠進行三甲基化(tri-methylate)。
此外,當研究團隊在實驗室的人類腦神經細胞中,利用藥物抑制劑和基因突變等方式,干擾EHMT1/GLP和EHMT2/G9a時,這些酵素在H3K23組蛋白位置上添加甲基化標記的能力便下降。總而言之,這項研究發現了組蛋白H3K23位置是EHMT1/GLP和EHMT2/G9a的甲基化標靶,且兩者將H3K23作為受質的甲基化活性有所差異。
Yegnasubramanian表示,在腦神經細胞之後,他們會更深入了解這些酵素無法正常運作時如何導致疾病,以及這些疾病與H3K23之間的聯繫;Taverna也表示,更好地了解酵素如何影響基因體的活性,能夠在生物學上提供寶貴的觀點,並幫助科學家針對疾病設計新的治療方式。
參考資料:
https://www.hopkinsmedicine.org/news/newsroom/news-releases/johns-hopkins-researchers-explore-the-concept-of-belief-changes-related-to-psychedelic-experiences
原始論文:
https://epigeneticsandchromatin.biomedcentral.com/articles/10.1186/s13072-022-00468-1
(編譯 / 吳培安)