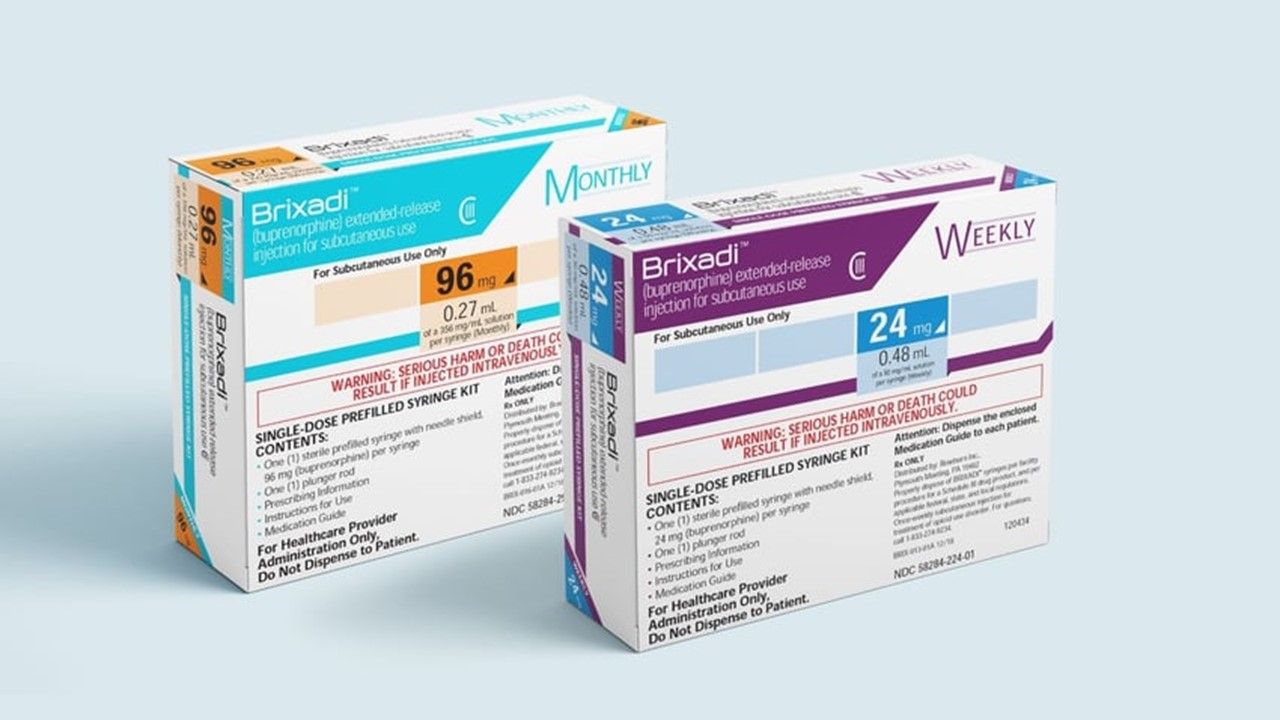
Brixadi的主要活性成份為buprenorphine,該成分是早在2002年就首次獲得FDA的批准,用於治療鴉片類藥物成癮。
Buprenorphine是一種安全有效的治療鴉片類藥物成癮藥物。根據美國聯邦衛生福利部物質濫用暨精神衛生防治局(SAMHSA)的數據,接受鴉片類藥物成癮藥物治療的患者可降低50%全因死亡率。
FDA建議以多種綜合方法來治療鴉片類藥物成癮症,在本月中,FDA與SAMHSA發布一封聯名信,呼籲鴉片類藥物成癮症綜合治療的重要性,並舉辦研討會,強調長效的治療需要特殊的劑量方案。
Brixadi被批准可每周或每月皮下注射治療,每週劑量為8 mg、16 mg、24 mg、32 mg;每月劑量為64 mg、96 mg、128 mg。
Brixadi最常見的不良反應包括,注射部位疼痛、頭痛、便秘、噁心、注射部位紅斑、注射部位皮膚瘙癢、失眠和尿道感染。
Brixadi仿單上列上黑盒警告(Boxed Warning),強調若透過靜脈注射該藥物可能造成嚴重死傷。
Braeburn指出,Brixadi預計9月在美國上市,會透過藥品風險評估暨管控計畫(Risk Evaluation and Mitigation Strategy, REMS)計劃,並且只能由醫療保健機構中的醫護人員管理,並強調該藥物必須與諮詢和社會心理支持一同形成完整的治療計劃。
FDA局長Robert M. Califf表示,buprenorphine是鴉片類藥物成癮患者重要的治療選擇,此次批准更擴大了患者對於劑量的選擇,且能夠讓鴉片類藥物成癮患者維持長期的健康狀態,FDA將在用藥過量預防指引(Overdose Prevention Framework)下持續推動物質使用障礙的療法開發。
Braeburn執行長Mike Derkacz表示,過去三年間,美國經歷鴉片類藥物濫用月來越嚴重,造成經濟和社會動盪。此次批准是向打擊鴉片類藥物濫用邁出重要的一步。
在本週(5月23日),FDA也批准了Indivior的鼻噴劑Opvee(nalmefene hydrochloride),可以用於緊急治療鴉片類藥物使用過量的12歲以上患者。
而兩個月前,Emergent BioSolutions的鴉片類過量解毒鼻噴劑產品Narcan獲FDA批准,可以非處方銷售(over-the-counter sale)途徑銷售,未來在美國即使沒有處方,也可透過零售通路、便利商店,甚至是加油站購買,也成為美國第一款非處方的鴉片類過量藥品。
參考資料:https://www.fiercepharma.com/pharma/braeburns-long-acting-brixadi-cleared-treat-opioid-use-disorder
(編譯/李林璦)