今(11)日,國家衛生研究院免疫醫學研究中心團隊發表最新研究成果,成功解開去磷酸酶DUSP22缺失促使泛素酶UBR2含量上升,引發T淋巴細胞過度活化導致自體免疫疾病之關鍵致病機制,將有助於開發新穎的醫療策略。研究成果已在今(2024)年1月,發表於全球知名期刊《Nature Communications》。
此研究是由國衛院免疫醫學研究中心譚澤華特聘研究員與莊懷佳副研究員,帶領施盈均博士、陳雪芬博士、王佳文博士組成研究團隊,經歷六年探索共同完成。
譚澤華特聘研究員團隊在2014年首度發現,去磷酸酶DUSP22是負責抑制T細胞過度活化以及自體免疫反應的關鍵負調控分子,接續與臺中榮民總醫院陳一銘醫師、臺北榮民總醫院免疫風濕科陳明翰醫師合作,研究全身性紅斑狼瘡(SLE)及僵直性脊椎炎(AS)致病成因與精準之生物診斷標記。
當時研究團隊分析臨床檢體發現,SLE及AS患者體內T淋巴細胞中的去磷酸酶DUSP22表現量,與正常T細胞相比大幅下降,且與疾病嚴重度相關。去磷酸酶DUSP22的缺乏造成蛋白激酶Lck異常地持續活化,促使T淋巴細胞大量分泌發炎性細胞激素,此為造成自體免疫疾病的元凶。
研究團隊進一步運用蛋白質體學、單細胞RNA定序等大數據分析,結合基因改造小鼠及各種生化實驗分析,發現泛素酶UBR2實為蛋白激酶Lck的上游活化分子,UBR2會誘使Lck泛素化並且促使Lck活化,此乃免疫學界從未觸及的嶄新發現。
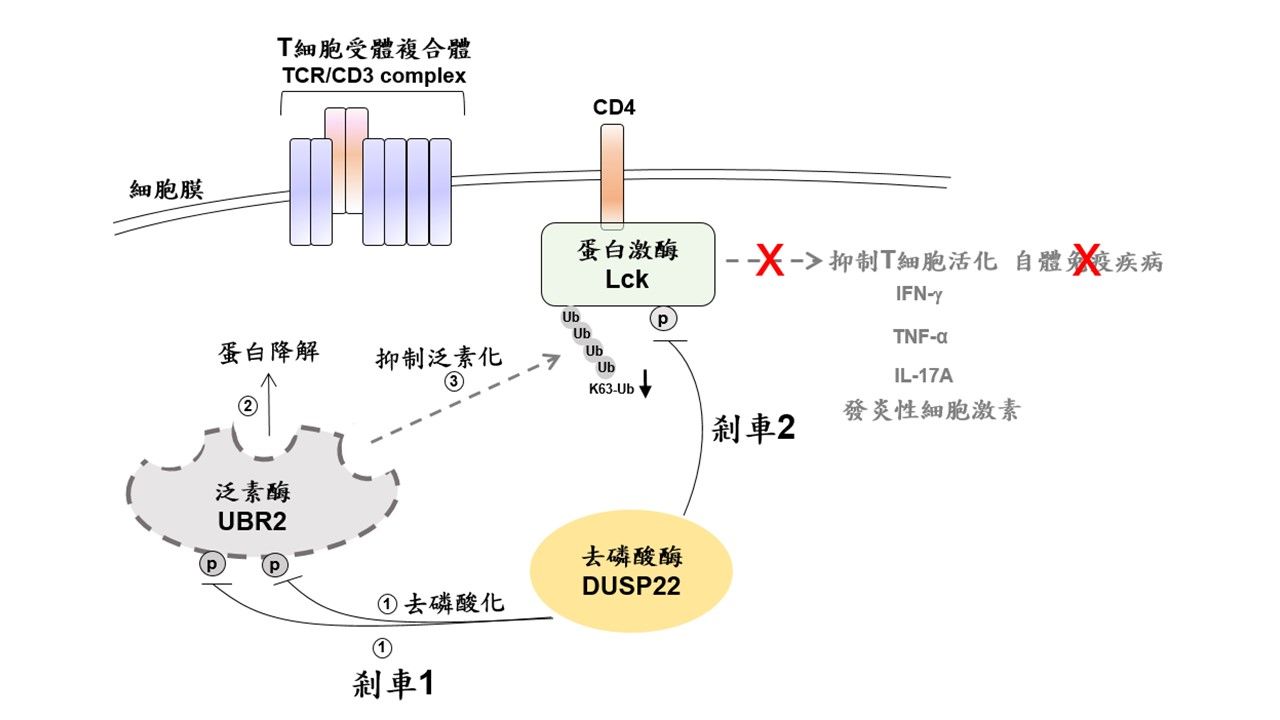
(圖/國衛院提供)
研究團隊證實,去磷酸酶DUSP22在正常T淋巴細胞中,透過如同「雙重煞車手續」徹底地解除T細胞之活化狀態,以避免過度活化引發疾病。研究發現DUSP22可以直接將泛素酶UBR2去磷酸化,並引發UBR2蛋白質降解,此為第一道煞車;另一方面,DUSP22也會將已活化的蛋白激酶Lck去磷酸化,並抑制Lck活性,此為第二道煞車。
因此,當T淋巴細胞中缺乏DUSP22時,泛素酶UBR2蛋白質會過度累積,進而使蛋白激酶Lck泛素化增加且持續性地活化,就如同高速行駛的跑車完全失去剎車功能一般,導致一發不可收拾的發炎反應。
研究團隊也分析SLE患者的臨床檢體,結果顯示,患者T淋巴細胞中泛素酶UBR2表現量增加,UBR2與Lck結合及Lck之泛素化也增加,證實去磷酸酶DUSP22的缺失及泛素酶UBR2上升為自體免疫疾病致病機轉之關鍵因素。
研究團隊進一步運用DUSP22及UBR2基因剔除小鼠進行自體免疫反應實驗,研究發現原本因DUSP22缺失所誘發大量產生的發炎性細胞激素,在進一步剔除泛素酶UBR2基因時,小鼠體內的發炎性細胞激素含量下降,且發炎情況大幅降低。
國衛院表示,本研究證實去磷酸酶DUSP22與泛素酶UBR2在T淋巴細胞的活化中扮演極重要的角色,抑制T淋巴細胞中UBR2表現量或活性是一種做為緩解自體免疫疾病的新思維,為自體免疫疾病的醫療策略帶來新的方向。
研究論文全文:https://link.springer.com/article/10.1038/s41467-024-44843-w









