陽明交大領軍高長、亞東 聚焦急性肺損傷開發胞外體核酸藥物
撰文記者 吳培安
日期2024-03-26
圖右:美國俄亥俄州立大學化學與分子工程學系暨陽明交大生物藥學所玉山學者李利教授。
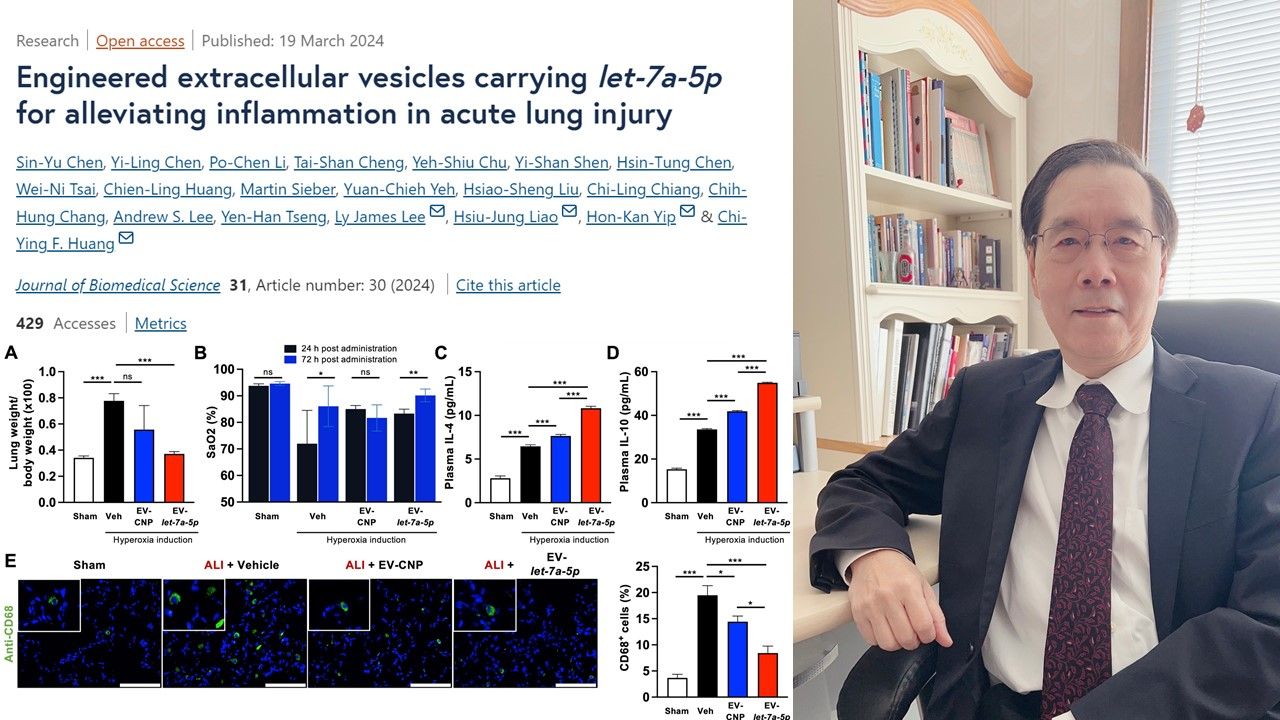
日前(19日),由陽明交通大學生物藥學研究所黃奇英教授、李利教授、高雄長庚葉漢根醫師、亞東醫院張至宏副院長與廖秀蓉研究員等人共同組成的研究團隊,開發了一種運用胞外體(extracellular vesicles, EV)包裹核酸藥物的創新基因治療,可用於對抗嚴重呼吸系統疾病——急性肺損傷,並顯示修飾性胞外體在降低肺部發炎和纖維化方面具有巨大潛力。這項研究刊登在《Journal of Biomedical Science》。
研究團隊表示,在新冠肺炎(COVID-19)疫情席捲全球後,新冠病毒重症比率約5%,而重症病患經常伴隨急性呼吸窘迫症(ARDS)。不過,過往研究顯示,即使現在呼吸治療醫學技術已大幅進步,嚴重ARDS死亡率仍高達88%。
黃奇英表示,這項研究起源於高雄長庚葉漢根醫師,所帶領的臍帶間質幹細胞治療的臨床研究;他們也透過文獻蒐集發現,有許多團隊投入幹細胞及其衍生胞外體,應用於急性肺損傷治療的研究。
不過,研究團隊認為由幹細胞衍生的胞外體效果有限,因此他們當時積極尋找可行的標的基因。由於過去研究團隊已開發許多對COVID症狀具有幫助與改善療效的中草藥,並發現其機轉與上調細胞內let7a-5p有關,該分子扮演著重要調控發炎因子的角色,便決定以let7a-5p為治療的關鍵標的基因。
其後,透過李利所開發的細胞電穿孔轉染技術,使臍帶間質幹細胞能夠產出富含let-7a-5p microRNA的胞外體,作為肺損傷治療的新方法。其後,再交由陽明交通大學團隊負責胞外體核酸藥物的製造與純化,後續配合亞東醫院進行免疫學相關測試,並與高雄長庚團隊進行動物學驗證。
研究成果顯示,這種療法的表現優於幹細胞胞外體,具有更好的免疫調節與抗纖維化發展的功效。
研究團隊表示,胞外體核酸藥物屬於新穎性生物製劑,對於如何修飾、大量純化、生產製程上,是目前國際上熱門的研究方向。期待透過其獨特技術,帶給藥物開發不同的概念。
目前研究團隊也在進行下一代細胞電穿孔技術的晶片開發,預計朝向大量製程與商品化開發,也預計在未來將胞外體核酸藥物推向臨床應用。
原始研究:
https://jbiomedsci.biomedcentral.com/articles/10.1186/s12929-024-01019-4
(責任編輯 / 吳培安)








