破解生物藥設計難題 BIOVIA整合諾獎AI工具助攻研發
BIOVIA指出,數十年來,藥物發現領域始終面臨著一大難題:下一個藥物該怎麼設計? 如今,隨著各類計算方法的快速發展,藥物開發不僅大幅減少濕式實驗(wet lab)的次數與實驗室操作時間,也有效加速、提升候選小分子藥物進入臨床開發的進程與機會。
不過,與小分子藥物開發相比,生物藥的計算設計工具因更具專業性,往往也只能適用於特定的應用,例如,在「單株抗體」等特定類型生物藥的設計過程中,研究者透過抗體親和力模擬、人源化預測、及免疫原性評估等專門演算法,來優化其療效與安全性,整體AI技術發展來說仍不如小分子藥應用成熟。
BIOVIA表示,由2024諾貝爾化學獎得主、華盛頓大學醫學院暨蛋白質設計研究所主任David Baker教授開發的AI模型RFdiffusion和ProteinMPNN,正逐步改善生物藥的發現模式。
為了方便研究人員使用效率,BIOVIA目前已經創了多種流程, 整合RFdiffusion與ProteinMPNN的應用,以加快生物藥物的設計與開發流程。
從結構生成到序列設計 特殊蛋白質設計不再困難!
那麼,RFdiffusion和ProteinMPNN與其它蛋白質預測軟體有何不同?
RFdiffusion為一款生成式AI算法,能將一組胺基酸「擴散」成蛋白質結構,所謂「擴散」,是從一組隨機的原子噪音集合出發,通過一系列結構調整的降噪步驟,使其逐步趨近於生物學現實中的功能性蛋白質結構。
「如果用一個生動的比喻來描述這一過程,它就像是一張模糊的照片,在經過多次迭代優化後,細節逐漸得以修復和完善,最終呈現出一張清晰的圖像。」
BIOVIA表示,RFdiffusion能夠解決生物治療藥物設計中的多項難題,例如設計一種能夠與病毒蛋白結合以中和病毒的生物製劑,或者一種能夠分解特定受質(substrate),以治療代謝紊亂的酶類治療藥物。
此外,該演算法在工業和生物技術領域也展現出巨大潛力,例如可設計用於催化特定化學反應的酶,或開發能夠適應極端條件(如高溫、低溫或特定pH值)的特殊蛋白質。
ProteinMPNN則是能夠根據蛋白質結構,預測出一個或多個可能的胺基酸序列,並能在產生可穩定摺疊、具良好結晶特性的蛋白質與胜肽序列方面取得重要突破,顯著加速蛋白質結構解析的進展。
不僅如此,ProteinMPNN的優勢在於它能夠生成多種蛋白質序列變體,為研究人員篩選出在安全性、人體吸收、分布、代謝、排泄與毒性(ADMET)和製造上表現最佳的候選藥物。
藉由結合ProteinMPNN、RFdiffusion的技術優勢,這兩種AI可共同應用於新型蛋白質設計,包括:全新的酶或抗體,並可同步評估其穩定性、活性、親和力與特異性等關鍵屬性。
此組合有望大幅提升設計效率,使生物學家能在進行昂貴且耗時的濕式實驗前,先透過模擬精準篩選與優化候選生物藥,加速創新療法的開發流程。
多模型輔助 打造更系統化蛋白質研發流程
因此,為了讓研究人員方便使用RFdiffusion工作流程,BIOVIA提供一種基於「基序骨架」(motif scaffolding)的蛋白設計方案,允許研究人員從現有蛋白質的特定部分(即基序)開始,設計一個包含該基序的完整的全新蛋白質骨架。
此種方法不僅能對蛋白的功能區域進行精確控制,還能透過不同的模型權重優化蛋白骨架設計,使其更適用於特定的蛋白質和複合體。
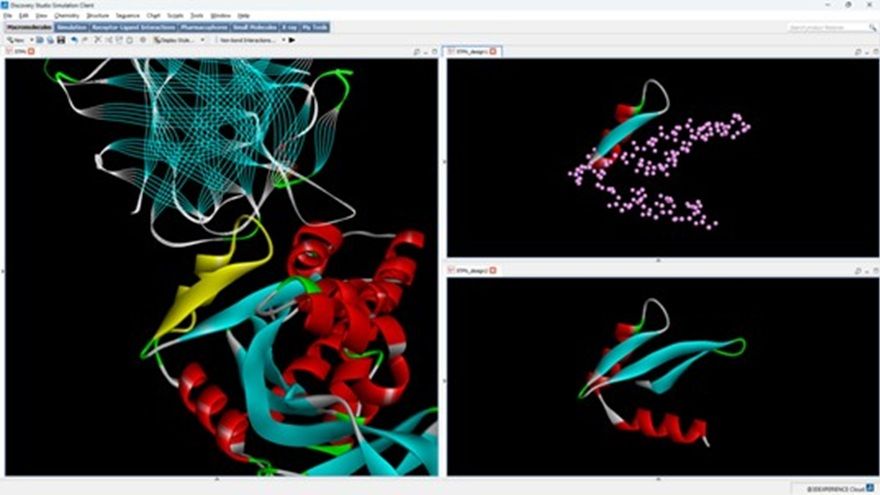
BIOVIA Discovery Studio Simulation用戶現已可使用RFdiffusion進行基序骨架設計。
此外,BIOVIA還提供另一項方案,讓用戶不僅能夠使用ProteinMPNN來定義序列殘基進行設計,還能使用David Baker教授團隊另外開發的LigandMPNN和SolubleMPNN模型。
LigandMPNN是一種以深度學習為主的蛋白質設計方法,可將蛋白質、小分子、核酸及金屬離子配體等作為額外的背景因素納入考量。SolubleMPNN則適用於將蛋白溶解度納入設計考量因素的研究場景,讓用戶可以決定所需的序列多樣性和可信度。
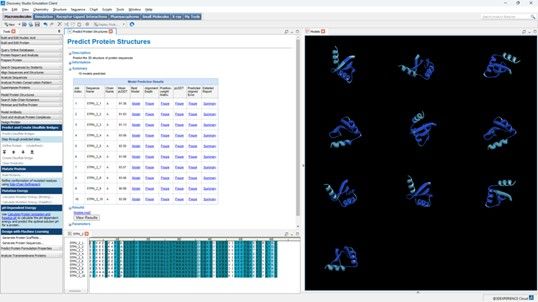
BIOVIA Discovery Studio Simulation用戶現已可使用ProteinMPNN生成新序列,並使用AlphaFold/OpenFold生成其3D結構,以供後續應用。
BIOVIA總結,這些AI工具正拓展分子建模與生物藥設計的可能性,協助研究人員更高效地探索與篩選候選藥物,並加速其在醫藥、農業與環境等多領域的應用落地。









