美國時間9日,美國賓州大學醫學院(Penn Medicine)在第65屆美國血液學會(ASH)年會中,公布了其與韓國AbClon共同研發的嵌合抗原受體T(CAR-T)細胞療法AT101的臨床一期試驗結果。賓大團隊表示,AT101與淋巴瘤的結合機制與已上市的CD19 CAR-T細胞產品截然不同,且在高劑量組的完全緩解率(CRR)達100%,成效相當驚人。這項研究已刊登在《Molecular Cancer》。
這項研究是由賓州大學佩雷爾曼醫學院及Abramson癌症中心共同執行。研究團隊表示,雖然CAR-T療法所帶來的變革,造福了許多已無治療選擇的血癌患者、甚至獲得長期緩解,但仍然有些患者依然治療無效,或治療後再次復發。
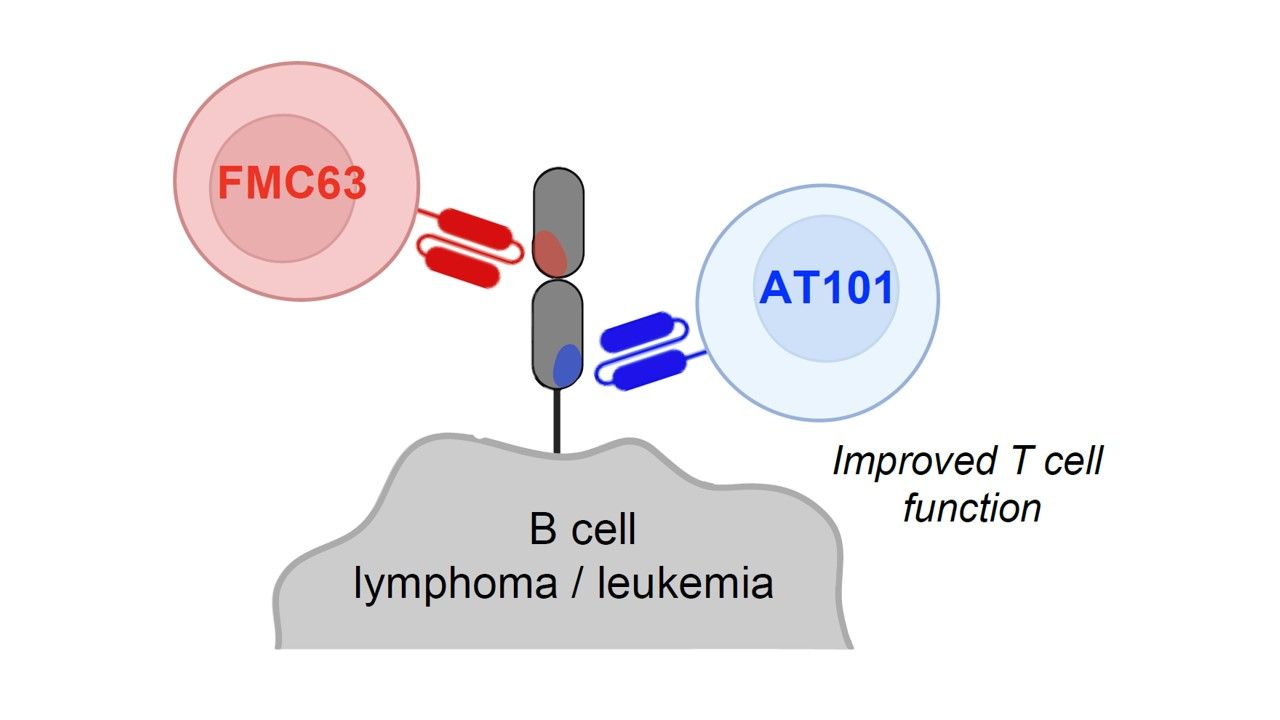
目前已獲批准、靶向CD19的CAR-T療法,都是經由相同的抗原表位(epitope)——FMC63,來鎖定癌細胞上的CD19。為了改善這類CAR-T的有效性、造福更多患者,血液學及腫瘤學助理教授暨淋巴瘤計畫科學主任Marco Ruella及其研究團隊,與韓國抗體公司AbClon Inc.共同開發出AT101。
研究團隊表示,雖然AT101也是以患者自身的T細胞製成,但他們利用一種稱作h1218的創新抗體,鎖定另一個與癌細胞的細胞膜更靠近的抗原表位,藉以靶向CD19。在臨床前研究中,研究團隊證實了h1218-CART19,相較於FMC63-CART19,減少了T細胞耗竭(exhaustion),可控性也更高。
其後,研究團隊在韓國進行了首次用於人體(first-in-human)的臨床一期試驗,並招募了12名罹患復發或難治型B細胞非何杰金氏淋巴瘤(NHL),但先前未接受過任何CAR-T治療的患者。
在最初的6名患者中,研究團隊驗證了AT101的安全性,其後又在6名患者中進一步增加治療劑量。結果顯示,在經過中位數6.5個月的追蹤期後,6名接受更高劑量的患者皆獲得完全緩解,且並未復發。
安全性方面,研究團隊表示這種CAR-T的副作用皆為可控,包括4名患者出現細胞釋放症候群(CRS),3名患者出現與免疫細胞相關的神經毒性症候群。不過,有1名患者出現等級3的敗血症但是已經解決,其後又在劑量限制毒性時間框架之外,遇到致命的中性球低下敗血性休克(neutropenic septic shock)。
Ruella指出,更改嵌合抗原受體(CAR)的設計,可能會劇烈地改變T細胞的運作,讓它能在其他CAR-T產品治療失敗的時候派上用場。不過,他們也沒有預料到在這項研究中,會看見這麼劇烈的差別。雖然還沒有進行隨機化試驗,但這些早期成果非常地令人振奮。
研究團隊表示,接下來會繼續進行臨床二期試驗,並招募更多患者加入,其中也會包含一些已經接受過靶向CD19 CAR-T療法的患者。
參考資料:
https://www.pennmedicine.org/news/news-releases/2023/december/car-t-cell-therapy-with-new-binding-mechanism-shows-promise
(編譯/吳培安)