製藥公司在拓展海外市場往往面臨各國單獨審查、資源分散、上市申請審查時間冗長等挑戰,可能導致錯過搶占市場之先機。東協聯合評估(ASEAN Joint Assessment, ASEAN JA)接受同一藥品可同時提交至少3個參與東協會員國藥品監管單位(National Regulatory Authorities, NRAs)之上市審查申請,由各NRAs國聯合評估並產出聯合評估報告,再由各國監管單位依該國程序做出最終核准決定,藥品有機會取得多國同步上市,有效降低重複審查成本與上市時程延誤。
ASEAN JA機制成形:三種申請路徑與簡化聯合評估程序,奠定跨國聯合評估基礎
東協在1990年代開始推動東協國家與世界衛生組織(World Health Organization, WHO)藥品監管法規協和並建立品質標準制度。然而,雖技術標準逐漸一致,但重複審查及審核時程差異仍是東協國家藥品上市的主要障礙。因此,東協國家與WHO於2015年合作研擬強化區域監管落地的專案,正式提出「聯合評估」的理念與架構,並於2016年成立了聯合評估協調小組(Joint Assessment Coordinating Group, JACG),並於2017年啟動首例試辦案件。該試辦計畫於2020年7月結束,而正式的JA機制在試辦計畫結束後推出。根據2024年修訂最新版本的「東協藥品聯合評估程序申請人須知」 (ASEAN Joint Assessment Procedure for Pharmaceutical Products Information for applicants),ASEAN JA適用條件、申請路徑及評估流程整理如下。
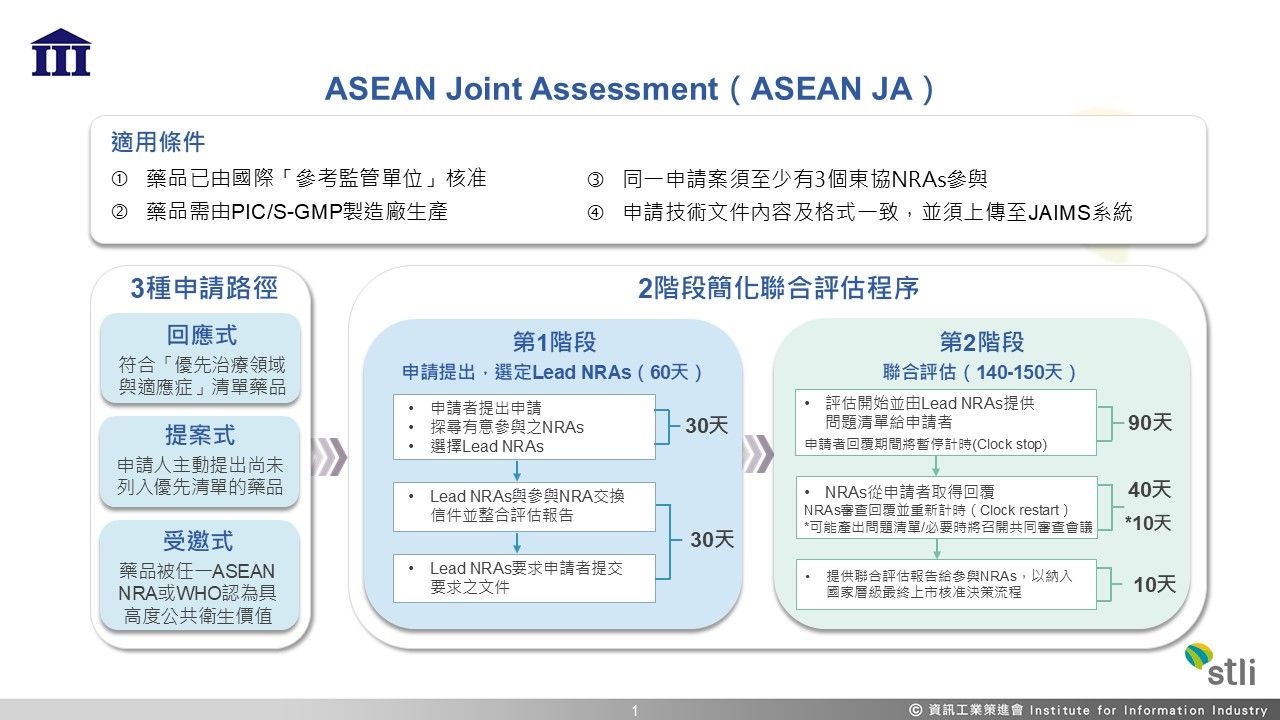
1. 適用條件
(1)產品已由「參考監管單位」 核准,或已通過 WHO 預認證,或經特殊監管途徑審查
(2)產品須由符合國際藥品檢查協約之藥品優良製造規範(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme Good Manufacturing Practice , PIC/S-GMP)要求的製造廠生產
(3)同一JA申請案須至少有3個東協NRAs參與,且各國須能取得詳細參考NRA或WHO 預認證及查廠報告
(4)提供之申請技術文件內容須一致,僅行政資料得依各國規定可有差異,並應滿足共同格式以電子檔形式上傳至WHO建置之聯合評估資料管理系統(Joint Assessments Information Management System, JAIMS),行政資料則分別繳交至各國
2. 3種申請路徑
ASEAN JA申請可經由3種路徑,但實際技術評估流程皆採簡化聯合評估程序(Abbreviated Joint Assessment procedure),不同路徑主要差別為案件選入及流程啟動標準。
(1)回應式申請(Responsive Application):產品符合ASEAN NRAs公布「優先治療領域與適應症」清單 ,申請人依公告提出申請
(2)提案式申請(Proposed Application):由申請人主動提出尚未列入優先清單的產品, ASEAN NRAs 評估是否接受作為 JA 候選案,彈性較大可涵蓋非優先領域之藥品
(3)受邀式申請(Invited Application):藥品被任一ASEAN NRA或WHO認為對多個東協會員國具有高度公共衛生價值,產品可屬任何治療領域,不須符合優先治療領域清單。該NRA可主動提議辦理JA,並徵詢其他成員國支持
3. 簡化聯合評估程序
ASEAN JA評估流程主要分為2大階段,第1階段由申請人提交意願表達,經至少三國同意後選定主導監管單位(Lead NRA),協調後續申請資料收集、機密文件交換等。第2階段由Lead NRA提出問題清單給申請人,待申請人回覆意見後進入NRAs技術評估(如有需要將召開多國聯合審查會議),最終產生聯合評估報告。該報告僅供參與國審核參考,各國仍可依該國規範作最終核准決策。
第一階段評估時程從申請至技術評估啟動約須60個日曆天,第二階段技術評估至聯合評估報告產出約須140-150個日曆天,申請者回覆意見期間將停止計時(Clock stop),各國在取得聯合評估報告後將進行國家層級的最終上市決策,各國評估時間相異,介於30-90個日曆天。
ASEAN JA可成臺灣布局東協市場新契機,作為歐美以外市場加速上市重要管道
在美國關稅與藥價政策造成全球市場不確定性升高的背景下,布局東協市場或為臺灣新藥開發廠商降低風險、加速拓展歐美以外國際市場可參考之策略,而ASEAN JA可成為進軍東協的重要管道。該機制針對已取得國際核准的藥品,透過單一窗口申請及多國同步技術評估,減少跨國重複審查作業、縮短審查時程,協助藥品在多個東協國家加速上市。臺灣新藥研發及製造能量已接軌國際標準,自2014年全面推動PIC/S-GMP以來已有超過150家西藥藥廠符合規範,加上新藥開發廠商多以歐美市場為首站,因此產品取得國際核准後,善用 ASEAN JA 可快速擴大在東協市場布局。另一方面,我國新藥開發廠商也常採臨床前期研發後期授權模式,掌握ASEAN JA機制將有助提升臨床設計、授權談判與市場評估能力。然而,ASEAN JA 為參考國際核准之加速審查機制,未具國際核准的產品較難納入,且聯合審查後各國仍保有最終上市與給付決策權,行政要求也可能不一致。因應此特性,建議臺灣藥廠可在研發早期即併入東協需求與國際標準,選定重點東協市場深化合作,並強化團隊多國法規與市場准入處理能力。
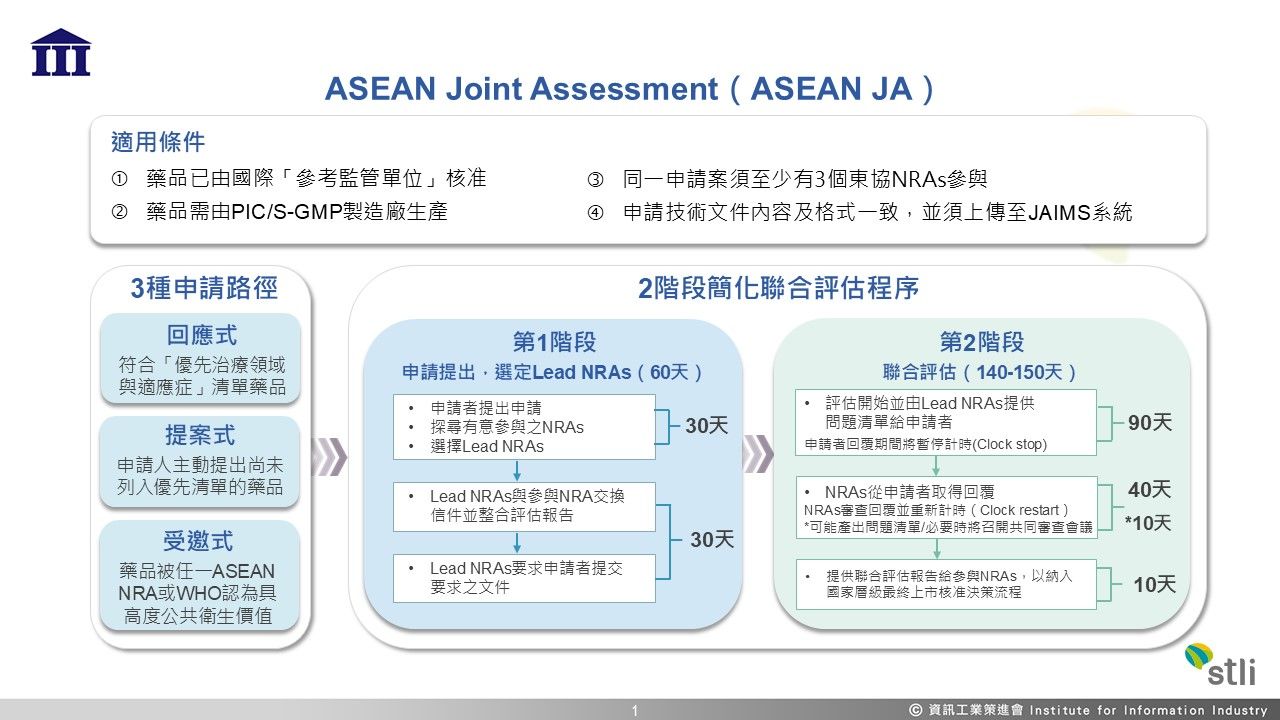
圖1、 ASEAN JA機制簡介 (資料來源:資策會科法所自行整理)
撰文/資策會科技法律研究所 張慧潔 法律研究員
資料來源:
- National Pharmaceutical Regulatory Agency [NPRA], ASEAN Joint Assessment Procedure for Pharmaceutical Products Information for applicants, (2024) https://www.npra.gov.my/images/2024/JACG/Information-for-applicants_Revision-3.pdf (last visited Dec. 02, 2025)
- 參考監管單位指WHO認定之嚴格監管單位(Stringent Regulatory Authority, SRA),或經 WHO 監管系統標準評估達到成熟度等級(Maturity Level)3 或 4 之單位,且通常能提供英文未編輯審查報告者。
- 特殊監管途徑審查如經歐盟EU Article 58 核准或美國FDA暫時核准之產品。
- National Pharmaceutical Regulatory Agency [NPRA], List of Priority Products For JA Activities, (2022) https://www.npra.gov.my/images/2023/jacg/List-of-Priority-Products-for-JA-Activities_Revision-2_Final-clean-version.pdf (last visited Dec. 02, 2025)