繼今年2月底剛獲美國FDA核准後,近(26)日,由嬌生(J&J)旗下楊森(Janssen)和中國南京傳奇生物(Legend Biotech)共同開發的CAR-T療法Carvykti (cilta-cel),再獲得歐盟委員會(EC)的上市許可,用於治療特定條件的成人多發性骨髓瘤(MM);在將於6月3~7日舉行的美國臨床腫瘤醫學會(ASCO)年會中,公司也透露將發布最新臨床結果,顯示該療法做為更前線治療也深具潛力。
EC本次批准Carvykti,用於曾接受過至少三項治療,包括:免疫調節劑、蛋白酶抑制劑和CD38抗體療法,且最後一次治療後疾病仍惡化的復發或難治性多發性骨髓瘤(r/r MM)成人患者。
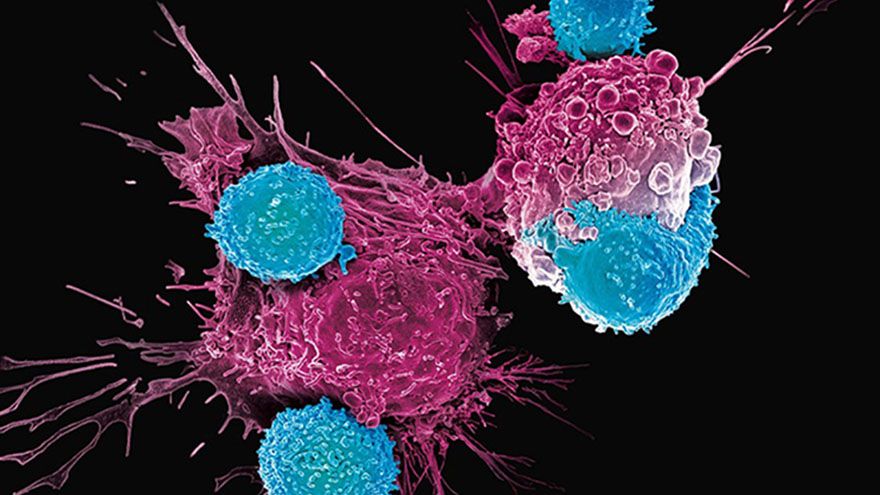
Carvykti以B細胞成熟抗原(BCMA)為標靶,本次批准和先前FDA的核准,同樣是基於1b/2期試驗CARTITUDE-1的結果。
該項納入97名復發或難治性多發性骨髓瘤患者的試驗顯示,患者整體緩解率(ORR)可達98%,其中有83%的患者,在中位數22個月的追蹤後,達到嚴格的完全緩解(stringent complete response, sCR)。兩年的疾病無惡化存活期(PFS)和整體存活(OS)比率,分別為61%和74%。
安全性上,根據先前的追蹤數據中,最常見的不良事件包含:嗜中性白血球減少(91%)、細胞激素釋放症候群(CRS)(88%)、發燒(88%)、血小板減少(73%)、貧血(72%)、白血球減少(54%)以及淋巴細胞減少(45%)等。
而近日,據外媒表示,在今年美國臨床腫瘤醫學會(ASCO)年會中,兩公司也將發布Carvykti用於僅接受過一項治療並於12個月內病情惡化者的試驗結果:Carvykti有望讓90%的患者病情獲得改善,或達到完全緩解。
美國FDA於今年2月28日,批准Carvykti用於治療復發或難治性多發性骨髓瘤,也使之成為由中國合作開發的CAR-T療法中,首款取得美國批准的項目。
Carvykti為一種經基因編輯的自體CAR-T療法,特點在於含有雙重BCMA表位結合部分,能藉以提高親和性和療效。它能夠辨識出表現BCMA的細胞,主要為惡性多發性骨髓瘤B細胞、晚期階段B細胞和漿細胞,並在辨識後立即促進T細胞活化、擴增、攻擊目標細胞。
2017年,楊森於與傳奇生物達成Carvykti開發與商化的獨家全球授權與合作協議。根據協議,傳奇生物先獲得了3.5億美元的預付款,且在後續開發、生產、監管和銷售上達到一定里程碑時,可再獲得額外付款。
今年2月11日,傳奇生物宣布該項合作協議,已達到兩項里程碑付款,其目前所獲里程碑金共計為2.5億美元。
該療法已在中國被納入突破性治療產品,並即將申請上市,日本的上市許可也正在申請中。
(編譯/巫芝岳)