仁新指出,DRAGON試驗為期兩年,採取隨機分配、雙盲,及安慰劑對照(2:1)的全球多國多中心臨床三期試驗,試驗共收案104位年齡介於12至20歲的青少年受試者(試驗組69位及安慰劑組35位) 所有患者均被診斷為斯特格病變,且在ABCA4基因中至少發現一個突變,萎縮病灶大小不超過3個視盤面積(7.62 mm²),以及最佳矯正視力(BCVA)為20/200或更好。
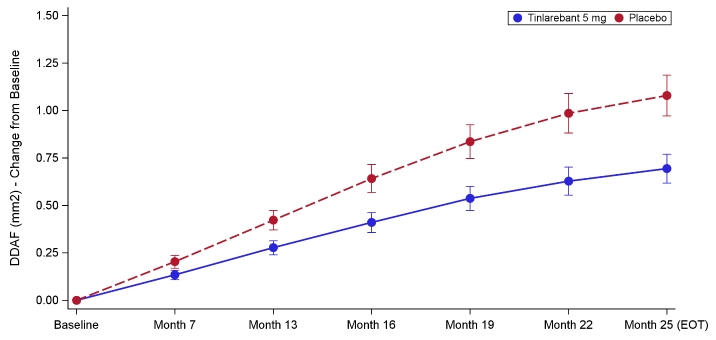 圖表:視網膜萎縮區域(mm²)-基線至各訪視期間Least Squares平均變化-研究眼
圖表:視網膜萎縮區域(mm²)-基線至各訪視期間Least Squares平均變化-研究眼試驗採用重複測量混合模型(MMRM)下的非結構化共變異數矩陣進行評估,Tinlarebant在主要療效指標上達標,視網膜成像顯示病灶增長速度相較安慰劑組顯著降低了35.7%(p=0.0033)。
另為考量所收集數據的縱向特性,並在DRAGON試驗的樣本量下保持模型的穩定性,採用MMRM下的自回歸共變異數矩陣進行事後分析,結果顯示治療效果為35.4%(p<0.0001)。主要療效指標在非研究眼(fellow eye)中同樣觀察到統計上顯著的療效,病灶增長率降低33.6%(p=0.041)。
此外,在關鍵次要療效指標中,Tinlarebant亦能減緩自體熒光病灶增長速率,其計算為視網膜萎縮區域與自發熒光病變區域(QDAF)的總和,研究眼降低33.7%(p=0.027);非研究眼降低32.7%(p=0.017)。
Belite董事長暨執行長林雨新表示,DRAGON最終試驗結果讓斯特格病變疾病治療帶來歷史性突破,Tinlarebant有望為首個治療這種具威脅性疾病的潛在新藥。
Belite Bio於美國時間1日公布三期試驗數據後,股價終場上漲12.06%至154美元;仁新醫藥則在臨床解盲前夕的5個交易日內大漲52.48%。
資料來源:https://investors.belitebio.com/news-releases/news-release-details/new-hope-people-living-disease-once-deemed-untreatable-belite
(責任編輯/彭梓涵)









