中央研究院基因體研究中心研究員張瑛芝開發了3D細胞培養技術――R3CE (Rapid, Reproducible, Rare Cell 3D Expansion)技術,經臨床驗證能在一到四週內,將單顆細胞增殖成3D結構細胞組織的平台,可應用於個人化醫療及臨床前藥物測試,並透過科技部價創計畫成立亞擴細胞生醫,未來可切入細胞治療、體外細胞培育、細胞資料庫等領域,期盼打通精準醫療的重要關節。
撰文/李林璦

Profile
中央研究院基因體研究中心 研究員
中央研究院生醫轉譯中心及應用科學研究中心 合聘研究員
合度精密生醫 (CellMax Life) 共同創辦人
亞擴細胞生醫 (AcroCyte Therapeutics) 共同創辦人
研究專長:
⑴ 發展生化奈米材料與其應用,從了解生物分子的功能與機制著手,結合材料工程設計,研發智慧仿生材料與介面。
⑵ 透過智慧材料介面和微流體技術,分離、純化和培養稀有細胞。
2013年以前,「精準醫療」這名詞對世界來說十分陌生,但近年來隨著次世代基因定序、循環腫瘤細胞 (Circulating Tumor Cell, CTC)、細胞治療技術的逐漸發展,已步入眾人視野中。
精準醫療該如何「精準」?中央研究院基因體研究中心研究員張瑛芝認為,關鍵在於「稀有細胞技術(Rare Cell Technology)」,稀有細胞技術對於檢測癌症患者的循環腫瘤細胞、孕婦的循環胎兒細胞(Circulating Fetal Cell, CFC)、幹細胞都非常重要。
張瑛芝心中的精準治療大藍圖,希望從液態活檢中分離出稀有細胞,培養患者細胞後,進行藥物篩選與治療,找到最適合患者、最有效的療法。
先前,張瑛芝曾開發出仿生膜塗層,能在數十億顆白血球中捕獲癌細胞,並且在過程中以「活捉」的方式,收集到腫瘤細胞,打破了循環腫瘤細胞技術靈敏度、活性兩大緊箍咒,並將此一「癌細胞捕手」技術技轉出來,於美國成立合度精密生物(CellMax Life)公司。
突破了精準醫療第一步─稀有細胞純化、分離後,下一步便是培養稀少細胞,於體外培養擴大,以便於做藥物篩檢、治療,張瑛芝一片片將精準醫療的拼圖拼上,攻入液態活檢的下一哩路。
單顆細胞也能養 打通精準醫療關節
張瑛芝中研院的團隊開發了3D細胞培養技術―― R3CE (Rapid, Reproducible, Rare Cell 3D Expansion)技術,由全合成的生物相容性聚合物塗層製作而成,無論是循環腫瘤細胞、組織切片、幹細胞或是永生細胞株,都可以藉由R3CE技術從單一顆細胞生成3D結構細胞組織,經臨床驗證能在一到四週內,將單顆細胞增殖的平台。
從初始播種小於300顆細胞,培養5天之後,實驗數據顯示,每個單細胞均可增值為具有400~1,000顆細胞組成的3D 細胞球。
「不管是要進行藥物篩選或細胞治療,都需要取出患者『活的』細胞,進行培養或改造,但是,通常培養細胞時,細胞之間的交互作用很重要,單獨一顆細胞培養十分困難。」張瑛芝表示。
此外,更困難的是,從人體取出的細胞是非常多元化、複雜的細胞族群,分離出需要的細胞也非常困難,以循環腫瘤細胞來說,分離出來的細胞數量太少,不足以做更近一步的分析研究或儲存。
目前的液態活檢大多是做DNA、RNA分析,看患者基因上的特定標靶,再利用細胞株或動物試驗進行藥物篩選,此方法無法達到完全個人化的藥物篩選,且動物試驗的時間也長,難以即時給予患者治療建議,因此,在臨床上最大的困境,就是治療方案都是猜測與不斷的嘗試,還沒有人可以在不針對特定靶點下,直接進行病人即時檢測。
若利用R3CE技術,可以在兩星期內,將患者腫瘤細胞在體外大量培養,而且這些細胞是使用患者患病當下的細胞直接進行放大檢測,是最即時且最切貼近患者實際狀況的。
「利用96孔盤培養細胞後,可同時進行多項藥物篩檢,並在一個月內告訴醫師與患者哪些藥物治療最可行。如此一來,便打通了精準醫療的關節!」張瑛芝說。
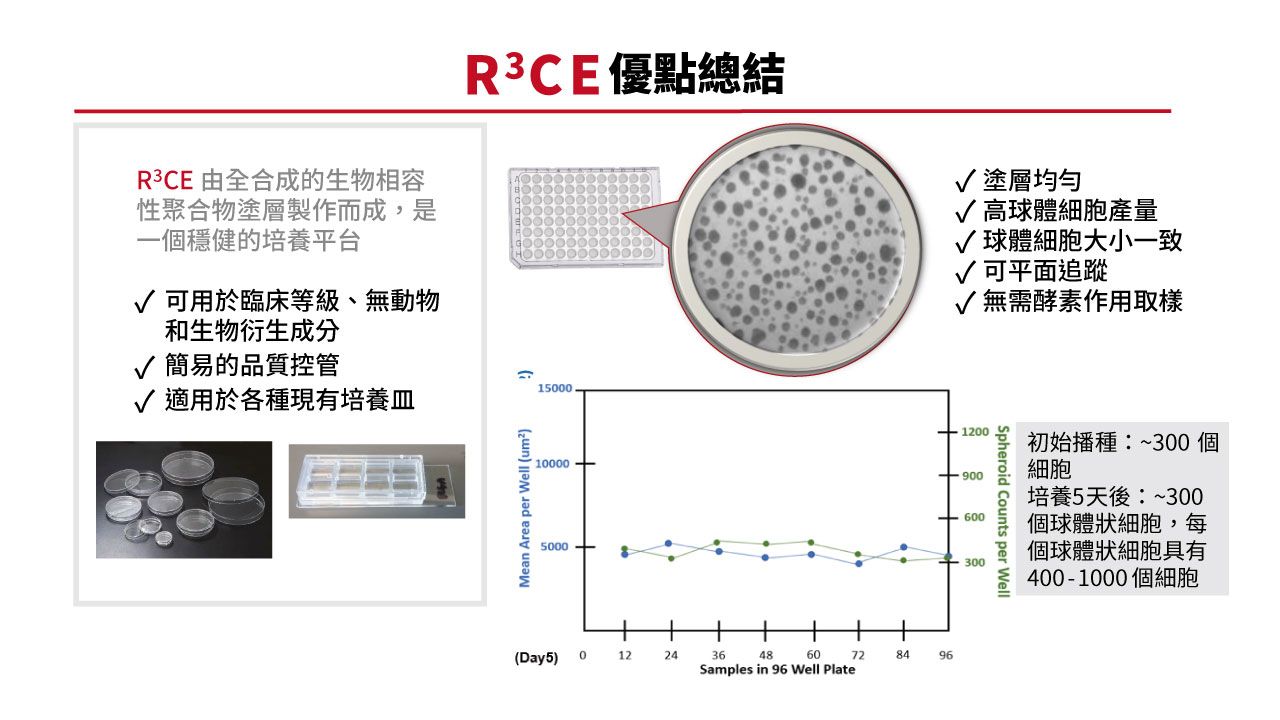
張瑛芝開發的3D細胞培養技術─R3CE (Rapid, Reproducible, Rare Cell 3D Expansion)技術,由全合成的生物相容性聚合物塗層製作而成,無論是循環腫瘤細胞、組織切片、幹細胞或是永生細胞株都可以藉由R3CE技術從單一顆細胞生成3D結構細胞組織,經臨床驗證能在一到四週內,將單顆細胞增殖的平台。(圖片來源/張瑛芝提供)
R3CE攻破口 預測自體細胞療法效果
R3CE技術讓張瑛芝更接近其夢想藍圖,但若要實現,還需要做更多的臨床試驗,所以張瑛芝後來與臺大醫院、臺北榮民總醫院、林口長庚醫院、美國史丹福大學癌症中心等,進行多年癌症化療藥物篩選的合作,目前的數據都非常令人信服。
R3CE技術除了突破癌症精準化療的瓶頸外,也與臺灣近年大力推行的自體細胞治療息息相關。
張瑛芝指出,自體細胞治療或所謂的個人化細胞治療從患者體內抽出的細胞,經過處理後打回患者體內,或許安全無虞,但卻缺乏事先可臨床驗證的策略,導致其療效連醫師都難以評估,可以說這個領域還處於十分渾沌的狀態中。
但也並非表示自體細胞治療無效,只是需要做更多的品質管制,給醫師更多的有效性數據,就如同任何蛋白質藥物、小分子藥物在申請藥證時,都有有效性的統計數據佐證。
「因此,若利用R3CE技術,將患者的腫瘤細胞進行同步分離及培養,那就可以將其免疫細胞直接針對其腫瘤細胞進行體外的有效性測試、篩選。這就可能成為全世界都要採納的黃金標準。」張瑛芝強調。
張瑛芝分享,事實上,這3D培養技術的開發早自2005年就開始,她的實驗室陸陸續續嘗試、建構雛形。
真正大量臨床驗證及優化則是近五年才開始著手。在這之前,「細胞治療」還方興未艾,因此,就算有技術,也難以切入市場,而現在,正是將R3CE技術應用於預測療效的最好方法與最佳時機。
目前,R3CE技術已成功培養乳癌、頭頸癌、大腸直腸癌、膀胱癌等多種癌症患者的循環腫瘤細胞、小鼠肝臟幹細胞類器官、結腸癌患者腫瘤組織、乳癌患者腫瘤組織以及結腸癌細胞株類腫瘤等等,亦可應用於幹細胞的生長與幹性的維持。
盼知識轉譯經濟 產學界達完美分工
該技術透過科技部價創計畫的加持,已於2021年中成立了亞擴細胞生醫股份有限公司 (AcroCyte Therapeutics),未來將提供R3CE平台,並發展個人化醫療及臨床前藥物測試。未來可切入細胞治療、體外細胞培育、細胞資料庫等領域。
經歷二次將學研技術商化的張瑛芝指出,知識經濟是臺灣產官學的共識,而「學界創業」則是知識經濟中不可或缺的一環,近年來已看到創新創業的氛圍在政府的支持下越來越活絡。
於是在這樣蓬勃發展的學術商化過程中,如何創造學術自由與商業成功的雙贏局面,是需要所有參與其中的人能夠以開放的態度不斷檢討與修正。張瑛芝認為,技術的創新只是商品化中的第一小步,更重要的是整體產學轉譯大環境的創新與包容。
「若產學轉譯的流程、分工能成形,我們就可以回歸於最有興趣、最擅長的第一線研究,繼續發想或許是十年、二十年後,或永遠不會出現的需求。這也是我們在生醫轉譯中心期許的目標。」張瑛芝表示。
>>本文刊登於《環球生技月刊》Vol. 87









