個人化mRNA癌症免疫療法的發展契機與優勢
隨著mRNA平台技術在COVID-19疫苗中取得巨大成功,癌症的免疫療法也迎來重大突破,其關鍵在於以mRNA產生癌細胞特有的標靶,新生抗原(Neoantigens)正是這種理想的標靶。新生抗原是因癌細胞基因突變而產生的異常蛋白質,每個病人的腫瘤都有獨特的基因突變圖譜,因此其新生抗原也各不相同。因應此概念,個人化mRNA癌症免疫療法也隨之而生:首先,針對病人腫瘤組織定序、識別特異性的新生抗原;接著,設計編碼新生抗原的mRNA序列,並透過LNP等載體送入病人體內表現,進而活化病人的免疫系統辨識,最終摧毀癌細胞。
相較於免疫查核點抑制劑,個人化mRNA癌症免疫療法可以針對病人腫瘤特異性的新生抗原,提高治療的精準度和有效性,且生產平台相對快速和靈活,可以應對腫瘤的異質性和突變速度;而與CAR-T比較起來,則因不涉及病毒載體或與外源基因的表現,安全性更高。
然而,這種新療法目前尚有諸多挑戰。從定序病人腫瘤基因、預測新生抗原到mRNA的設計與生產,過程涉及複雜的技術與生物資訊學分析。現有的監管框架主要針對大規模生產的標準化藥品,無法完全適用。FDA與EMA皆尚未特別針對mRNA療法訂定相關指引,目前係以基因療法的相關指引將mRNA療法納入監管。
英國MHRA發布《個人化mRNA癌症免疫療法指引》草案
英國藥物及保健產品管理局(Medicines and Healthcare products Regulatory Agency, MHRA)在此背景下,於2025年2月發布《個人化mRNA癌症免疫療法指引草案》(Draft guideline on individualised mRNA cancer immunotherapies),意為這類新興療法的開發與監管,提供一個清晰且全面的框架。指引草案徵求意見至2025年3月31日。本指引草案涵蓋多項重要的監管議題,以下重點簡述:
1. 監管分類:
- 目前個人化mRNA癌症免疫療法的上市途徑將被歸類為先進療法藥品 (Advanced Therapy Medicinal Products, ATMPs),子分類為基因療法(Gene Therapies)。
- 考量到在實務風險上,mRNA療法並不像傳統的基因療法會將外源基因整合到病人的基因組中,故MHRA將考慮為不編輯病人基因的核酸療法新增ATMP子分類,以讓監管要求能與風險程度匹配,避免多餘的監管障礙。
- 目前化學合成的寡核苷酸以化學藥品的方式進行監管。考慮未來可能會有不依賴體外轉錄(in vitro transcription, IVT)等生物合成方式製造mRNA的技術,MHRA也考慮將化學合成的 mRNA療法歸類為ATMP,以確保其能遵循必要的相關規範。
2. 病人樣本的收集、儲存與分析:
- 引草案要求病人樣本收集與儲存的監管應遵循英國《人體組織法案 2004》(Human Tissue Act 2004) 或《蘇格蘭人體組織法案 2006》(Human Tissue (Scotland) Act 2006),但指引草案未提及《人體組織法規 2007》(Human Tissue Quality and Safety for Human Application Regulations 2007),因為從病人身上收集的樣本不構成最終產品的一部分,也不是產品的起始材料。
- 產品設計涉及生物資訊學分析以及新生抗原識別與選擇。指引草案強調,所有流程都必須維持高度的可追溯性,確保病人樣本、基因序列與最終產品之間的連結。
3. 使用人工智慧技術的監管注意事項:
- 用於分析病人基因資料,識別、選擇新生抗原的人工智慧(AI)。可以根據醫療器材或體外診斷路徑進行監管。
- 用於自動化和加速製造過程的AI工具則應該受到藥品優良製造規範(GMP)監管。更變生產過程中的AI工具,也必須評估其對產品安全性與有效性的影響。
觀察重點
本指引草案中特別值得注意,MHRA考慮為個人化mRNA癌症免疫療法增加新的ATMP子分類以跟傳統基因療法做出區隔。這點呼應了歐盟《醫藥品包裹》(Pharmaceutical Package)修訂版草案預計更動基因治療藥品定義(圖1),將mRNA相關療法與傳統基因療法做出區分(mRNA療法為第二型,傳統基因療法為第一型)。兩者都顯示了監管機關漸漸對mRNA療法的作用機制有更細緻深入的了解,並依據實質的安全性考量作出區別。未來在國際間mRNA療法的相關監管很可能會隨此趨勢,制定出與傳統基因療法不一樣規範要求,值得後續追蹤觀察。
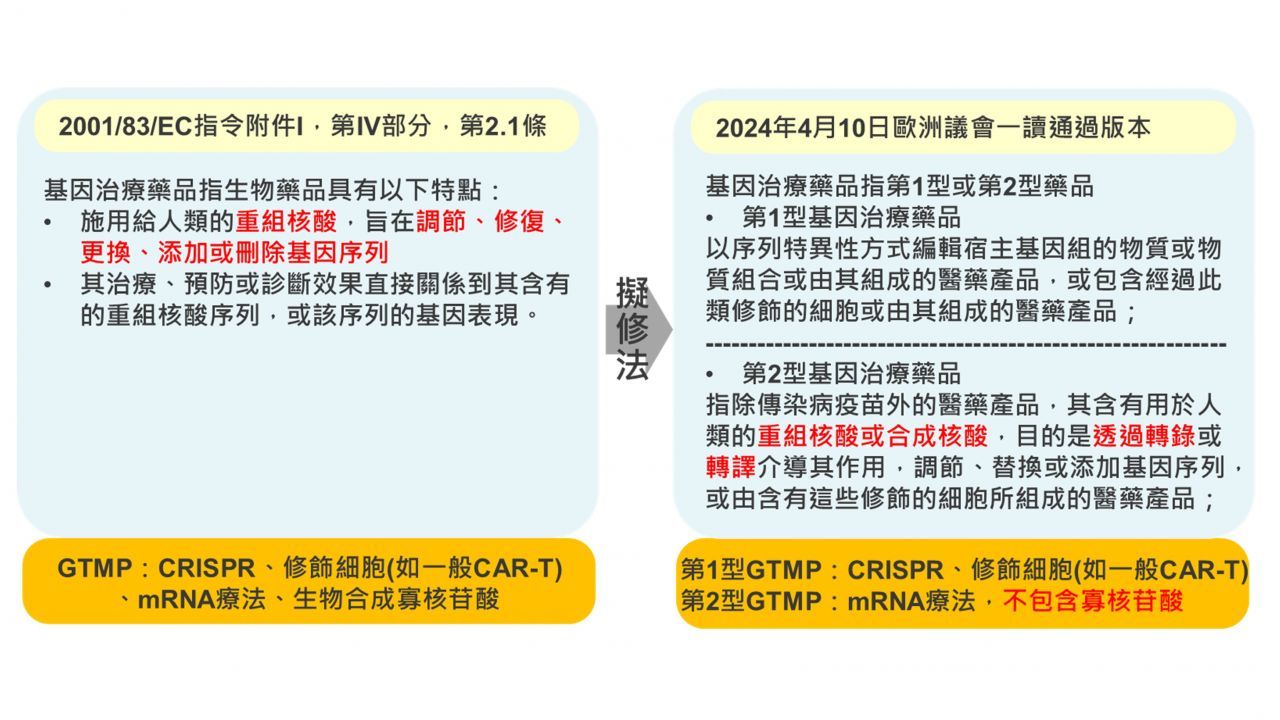
歐盟《醫藥物包裹》修訂前後基因治療藥品之定義

歐盟《醫藥物包裹》修訂前後基因治療藥品之定義
撰文/資策會科技法律研究所 楊子平/法律研究員









