工研院研發「新冠核酸檢測系統」 6月底試量產
2020-04-15 / 記者 彭梓涵
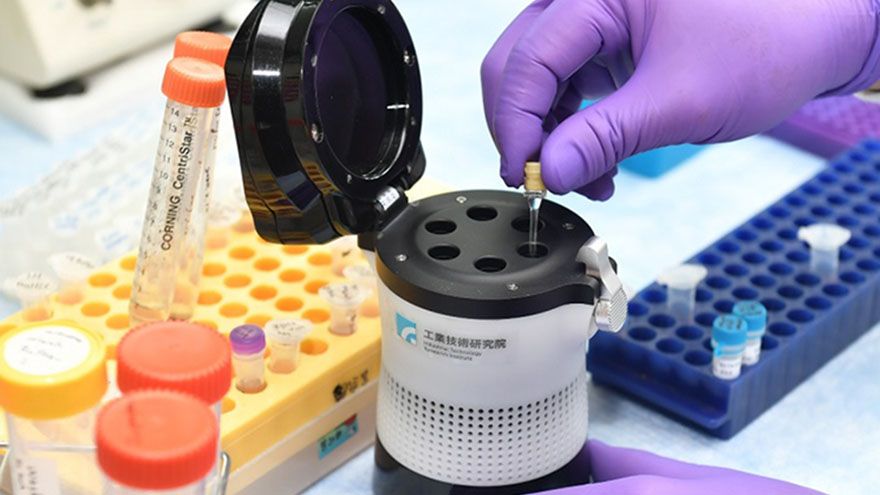
今(15)日,工研院舉辦第二場防疫科技說明會,發表其輕型、1小時快速核酸檢測系統「疫開罐」,目前該檢測已完成國內專案製造30例陰30例陽檢體測試,準確率達90%。工研院院長劉文雄表示,新冠肺炎症狀像感冒,希望能在病症前期就快速篩檢出來,已提早隔離減少傳染機會。工研院也朝此方向前進,與國防預醫所、醫院與四家國內業者合作,開發輕型新冠病毒核酸檢測系統「疫開罐」。(圖片來源:節錄線上記者會)工研院生醫與...
《Nature》子刊:全球115項COVID-19研發疫苗 5項已進臨床
2020-04-13 / 記者 彭梓涵
截至2020年4月8日,全球有115種COVID-19候選疫苗正在研發。近(9)日,流行病防範創新聯盟(CEPI)盤點全球疫苗發展近況,發表在《NatureReviewsdrugdiscovery》期刊上。數據顯示,目前有78種疫苗正處於研發與臨床前階段、37種未更新狀態、5種已進入臨床。全球115種疫苗5種進入臨床核酸疫苗靈活性最大5種已進入臨床的疫苗包括,美國Moderna的mRNA-1273...
台康與台疫苗廠簽約協助疫苗開發、亞獅康暫緩新加坡異位性皮膚炎臨床招募
2020-04-13 / 記者 彭梓涵
1.台康與台疫苗廠簽約協助疫苗開發台康(6589)為加速台灣抗新冠病毒疫苗的開發,與國內一家疫苗開發廠商簽訂材料移轉協議(MTA),台康生技將其細胞株技術平台(EGCHOK1sv)提供給此疫苗開發廠商,加速其與美國國衛院(NIH)開發以新冠病毒完整S蛋白為抗原的抗新冠病毒疫苗合作項目。2.因疫情影響亞獅康暫緩新加坡異位性皮膚炎臨床招募亞獅康-KY今(13)日宣布,鑒於新加坡政府近日頒布防堵新型冠狀...
對沖基金爆賺紅人Bill Ackman 砸金聯亞旗下 Covaxx 新冠檢測新公司
2020-04-13 / 記者 彭梓涵
聯亞今年才新成立的子公司Covaxx,受疫情期爆賺成名的對沖基金經理人BillAckman個人投資,也連帶受人矚目。Covaxx主要開發血清抗體檢測產品,Ackman公開宣稱,該公司新冠檢測在中國武漢已檢測超過萬人的確認案例樣本,現正在美國聖米格爾縣(SanMiguelCounty)啟動免費檢測驗證。報載Ackman自2月底來,於美國疫情拉警報前後短短不到一個月,以其靈活的作空操作模式爆賺約26億...
輝瑞7.48億美元攜手BioNTech 新冠mRNA疫苗4月進人體試驗
2020-04-10 / 記者 彭梓涵
輝瑞(Pfizer)於3月初宣布與BioNTech合作開發新冠肺炎(COVID-19)疫苗。美國時間(9)日,雙方公開合作細節,BioNTech將為BNT162COVID-19疫苗計劃提供多種mRNA候選疫苗,預計將於本月進行人體測試。Pfizer也將支付1.85億美元前期付款,未來疫苗開發順利BioNTech可獲得5.63億美元的里程碑金。 這項合作將會利用BioNTech專有的mRNA疫苗平台...
新冠病毒檢驗醫材徵案說明會: 簡化流程 加速業者一個月內完成審查、上市
2020-04-10 / 記者 彭梓涵
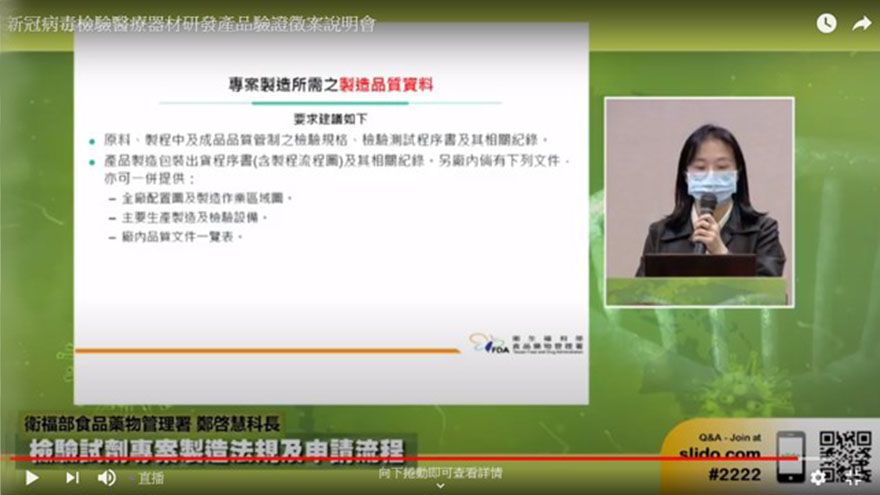
今(10)日,嚴重特殊傳染性肺炎中央流行疫情指揮中心研發組,招開「新冠病毒檢驗醫療器材研發產品驗證徵案說明會」,向各企業與研發機構說明申請資格、送件標準、審查原則、送審文件及費用等,以利各界提出申請,加速我國檢測研發產品驗證及上市。國衛院院長梁賡義擔任研發組組長並主持現場與線上會議,現場也有超過23家業者參與Q&A。專案申請加速一個月內完成審查衛福部食藥署管理局科長鄭啓慧,為檢測試劑專案製...
國衛院COVID-19快篩招商 22家廠商搶申請 最快3個月內量產
2020-04-08 / 記者 彭梓涵
今(8)日,國衛院與國防醫學院預醫所,共同開發開發的10-15分鐘新冠病毒快篩試劑,舉辦「非專屬授權」技術說明會,徵求具備快篩試劑研發生產製造相關經驗上下游廠商,進行技轉,目前已有22家廠商進行專案申請,最快未來三個月內可量產上市。國家衛生研究院梁賡義院長表示,國衛院與國防醫學院預醫所利用過去抗SARS病毒抗體為基礎,挑選出可辨識新型冠狀病毒(SARS-CoV-2)的抗體,目前所開發的雛型,已能辨...
瑩碩超前部屬 投產阿奇黴素以利日後防疫所需
2020-04-06 / 記者 彭梓涵
國際臨床研究初步證實使用羥氯奎寧合併阿奇黴素治療,能有效清除新冠肺炎(COVID-19)。瑩碩生技(6677)為臺灣唯一擁有阿奇黴素(日舒)懸浮液藥證,今(6)日宣布將展開投產,掌握原料藥供應來源,未來可以在第一時間配合政府的防疫政策需求使供應無虞。瑩碩指出,羥氯奎寧(Hydroxychloroquine,HCQ)一般用在治療瘧疾、狼瘡及類風濕性關節炎,阿奇黴素可以攻擊呼吸道中躲在生物膜裡面的細菌...
瑞基海洋 COVID-19檢測獲TFDA武漢肺炎專案製造核准、台杉基金將完成台、美兩間投資案
2020-04-06 / 記者 彭梓涵
1.瑞基海洋COVID-19檢測獲TFDA武漢肺炎專案製造核准今(6)日,衛福部公布,「因應武漢肺炎申請醫療器材專案製造之核准名單」,瑞基海洋新型冠狀病毒檢測試劑、自動核酸分析儀、萃取耗材組、試劑對照陽性組獲得批准,為臺灣首個自主研發獲得批准的檢測。瑞基2月公布完成,新冠肺炎病毒檢測試劑研發,該檢測是採用WHO與美國國家生物資訊中心(NCBI)及全球共享禽流感數據倡議組織(GISAID)基因庫所公...
《Science Advances》3D列印生物墨水心臟貼膜 增加受損心肌再生能力
2020-04-01 / 記者 彭梓涵
3月25日,由首爾聖瑪麗醫院和香港城市大學組成的國際聯合研究小組,開發一款生物墨水(bioink)的心臟貼膜,此貼膜是由肝細胞生長因子的工程化幹細胞組成,在動物實驗中證實可以增強幹細胞再生血管功能,從而改善心肌梗塞。相關研究已發表在《ScienceAdvances》期刊上。心臟是血液在體內循環的驅動力,但當血管阻塞或心肌受損時,通常會給予血管支架合併抗凝血藥物來控制,但若病情惡化,患者最後則需進行...