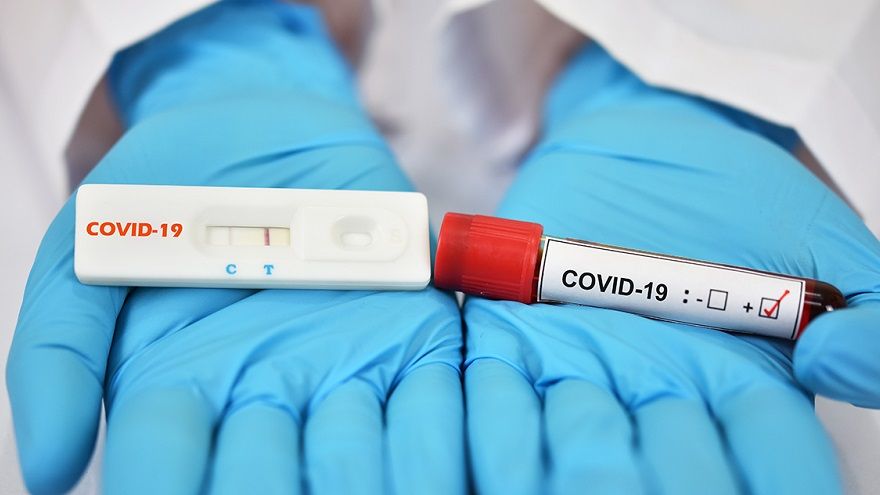
EUA逐步退場!205款新冠檢測6月底到期 15家轉申請正式許可
2023-06-23 / 記者 彭梓涵
衛福部食藥署日前接受媒體聯訪表示,將有205款以EUA取得販售許可的檢測試劑,將在6月30日到期,屆時相關的產品將不能製造、輸入,需重新申請正式的醫材許可證。不過食藥署也透露,目前也有15家業者申請正式許可證,其中已有業者取得許可。 因新冠疫情而啟動有別於一般有別於產品上市法規途徑的緊急使用授權(EUA),在隨著5月1日指揮中心解編,已有51款新冠檢測試劑因指揮中心解散而屆期,剩下的檢測產品其EU...
以色列84萬人真實世界數據支持 FDA再擴大輝瑞新冠疫苗12至15歲第三加強劑EUA
2022-01-04 / 記者 彭梓涵
美國時間3日,輝瑞(Pfizer)與BioNTech宣布,美國食品藥物管理局(FDA)已擴大其COVID-19疫苗於12至15歲兒童第三劑加強劑(booster)的緊急使用授權(EUA),同時也將第二與第三劑接種時間間隔,從六個月減少至五個月。 FDA的批准是基於以色列一項50歲以上成年人的真實世界數據(RWD)分析,該研究共分析84萬人數據,其中75.8萬人接受輝瑞疫苗第三劑加強劑,根據2021...
新冠疫苗批准更嚴格!FDA新指南:打完疫苗後需兩個月追蹤、召開諮詢委員公開會議
2020-10-08 / 記者 劉端雅
美國時間7日,美國FDA局長StephenHahn接受美國醫療網站WebMD專訪時表示,FDA未來在授予任何COVID-19疫苗緊急使用授權(EUA)之前,會先召開疫苗和相關生物產品諮詢委員會(VaccinesandRelatedBiologicalProductsAdvisoryCommittee,VRBPAC)公開會議,討論疫苗生產商提交的數據,其安全性和有效性是否足夠獲得EUA授權。相較於6...