2024年12月,美國食品藥物管理局(FDA)發布了「快速核准途徑」(Accelerated Approval)新指引草案。資策會科技法律研究所與環球生技攜手,帶您在5分鐘內了解什麼是快速核准途徑,以及最新的指引草案的修正內容。
FDA作為全球藥品監管機關的領先者,自1987年以來數度修整加速批准途徑的審核機制,至今已發展出替代終點(surrogate endpoint)、中間終點(intermediate endpoints)、確認性試驗(confirmatory trials)、撤銷程序等主要架構,以平衡使用加速審核途徑的利弊。
此次的新指引草案中,新納入的內容則包括:要求藥廠在加速核准後進行確認性試驗以驗證藥物的臨床益處,並賦予FDA在加速核准前或後的特定時間內,要求藥廠進行確認性試驗的權力等。
什麼是加速核准途徑?為什麼要修新版?
FDA的宗旨,是為罹患嚴重或危及生命疾病、且缺少有效療法的病人,不斷尋求盡快讓患者可取得安全、有效新藥的途徑。
而對法規監管單位而言,加速核准途徑能達成解決藥品短缺、滿足醫療需求、促進新興療法產業發展等重大目的,同時克服這些療法未經證實長期益處和安全性風險的疑慮。
1980年代,愛滋病(AIDS)的流行凸顯了快速開發核准藥物的迫切需求,也促使FDA在1987年首次允許病人在臨床試驗中使用上處於實驗階段的藥物,這也為FDA往後的加速核准途徑奠定了基礎。
在這之後,加速核准途徑的發展,還經過了幾個重要的里程碑:
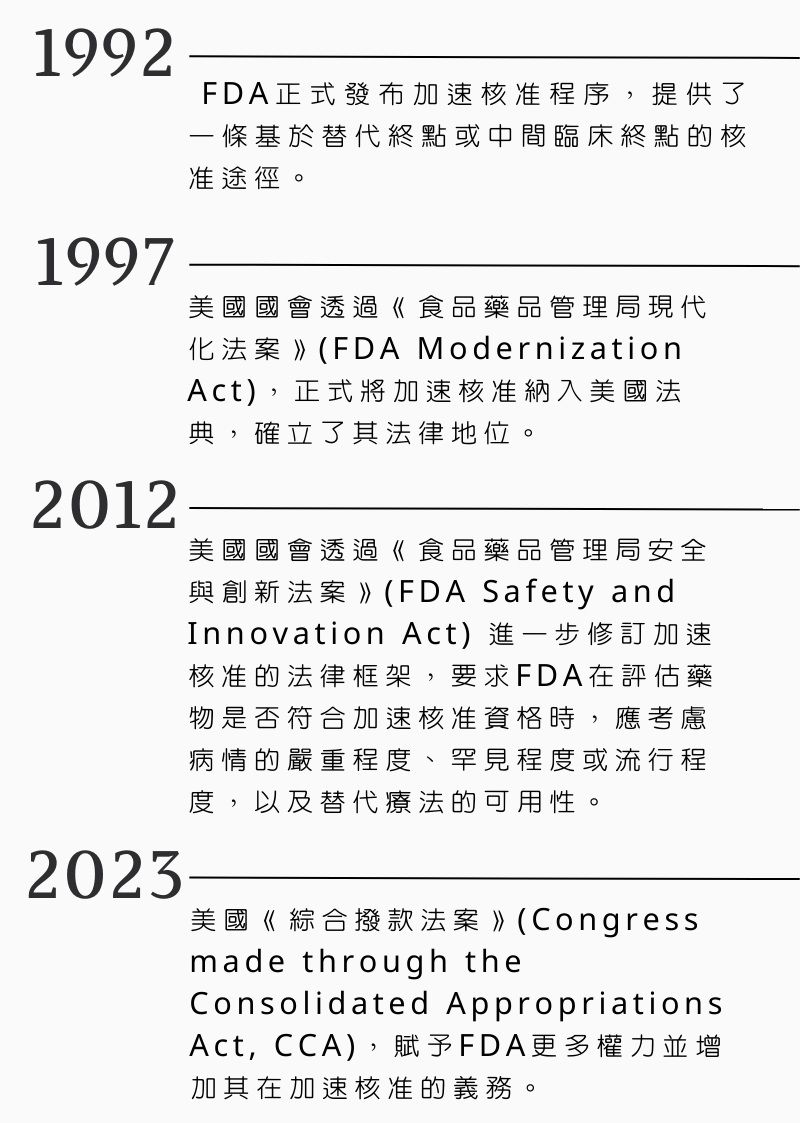
美國FDA自1987年以來,數度修整加速批准途徑的審核機制。(製圖/本刊資料中心)
因此,FDA於2024年12月5日頒布關於加速核准途徑的新指引草案,徵詢意見至2025年2月4日。其新納入的內容,主要針對確認性試驗。
首先,指引草案要求藥廠在加速核准後進行確認性試驗,以驗證藥物的臨床益處;第二,賦予FDA在加速核准前或後的特定時間內,要求進行確認性試驗的權力;第三,要求FDA在核准藥物時,必須明確說明確認性研究的條件,例如招募目標、研究完成的目標日期等。
什麼樣的藥物或療法,適用FDA加速批准途徑?
一項藥物是否符合FDA加速核准的標準,包含以下幾個關鍵面向。首先,這項藥物的目標適應症,必須是用於治療嚴重或危及生命疾病,且該疾病會導致嚴重的功能障礙、危及生命或造成病人死亡。
該藥物本身還必須以滿足「未滿足之醫療需求」(unmet medical need)為目標,即該類患者目前缺少有效療法、或是現有的療法存在顯著缺陷,例如:療效有限、安全性問題、給藥方式不便等。
針對這一點,FDA在批准藥物是否符合加速核准資格時,應考慮病情的嚴重度、罕見度或流行程度,以及替代療法的可用性或缺乏情形綜合考量。
當然,即使是加速批准,這些藥物也必須證明能夠提供有意義的治療益處,且與現有療法相比,新藥必須對病人的治療效果產生顯著的正面影響,因此設計了替代終點、中間臨床終點、確認性試驗等方式。
用預測取代實際測量:替代終點、中間臨床終點
所謂的「替代終點」,通常是生物標記(biomarker),例如實驗室測量、放射影像、身體徵兆或其他測量值。這些測量值被認為可以預測臨床益處,但本身不是臨床益處的測量值。
例如,地中海貧血症患者的鐵儲量減少,被認為可預測由體內鐵過載引起的輸血相關不良事件的減少;對患有中度至晚期肝纖維化的代謝功能障礙相關脂肪性肝炎(MASH,舊稱為非酒精性脂肪性肝炎)成人患者而言,肝臟發炎或纖維化程度,被認為可預測對患者的長期臨床益處。
另一方面,「中間臨床終點」則是指對藥物療效的測量,相較於不可逆轉的發病率或死亡率的效果,可以更早進行測量的指標。當藥物被認為可預測對不可逆轉的發病率、死亡率或其他臨床益處的效果時,可以支持加速核准。
FDA草案指引也提供了一項以中間臨床終點支持加速核准的案例:由bluebird bio開發的基因療法Skysona,是一種治療4~17歲男孩活動性腦性腎上腺腦白質營養不良症的療法,其批准依據是在第一個神經功能評分≥ 1後24個月無重大功能障礙(MFD-free)的存活率。
該療法在2022年9月獲得了加速核准,不過bluebird被FDA要求必須進行上市後研究,以確認長期無重大功能障礙的存活率。
加速批准不等於完全批准!確認性試驗把關
不過,加速批准並不意味著完全批准。FDA在授予加速核准之前,會先設定藥廠執行確認性試驗的條件,包括:招募目標、研究完成的目標日期和其他里程碑等,並確保藥廠已在進行確認性試驗。
確認性試驗必須在加速核准後完成,以驗證、描述對不可逆轉的發病率、死亡率或其他臨床益處的效果。
確認性試驗的目的,是評估能直接測量並支持加速核准的臨床終點,針對的通常是與研究同樣疾病的患者群體。然而,在某些情況下(例如罕見疾病),可能難以招募到足夠的患者來進行傳統形式的確認性試驗。
針對這種挑戰,FDA可能會同意採用替代方法,例如在相關但不同的患者群體中進行確認性試驗,或者使用相同的替代終點,進行更長時間的研究評估。
此外,即使獲得加速核准,藥物的核准也可能會被撤銷!在FDA的草案指引中,便描述了數項適用撤銷加速核准的情況。
這些情況包括:藥廠未能進行所需的核准後研究,包括未能在FDA規定的時間內完成確認性試驗;確認性試驗未能驗證預期的臨床益處;出現新證據證明藥物在核准的使用條件下不安全或無效;藥廠散布虛假或誤導性促銷材料等。
參考資料:
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/accelerated-approval-expedited-program-serious-conditions









