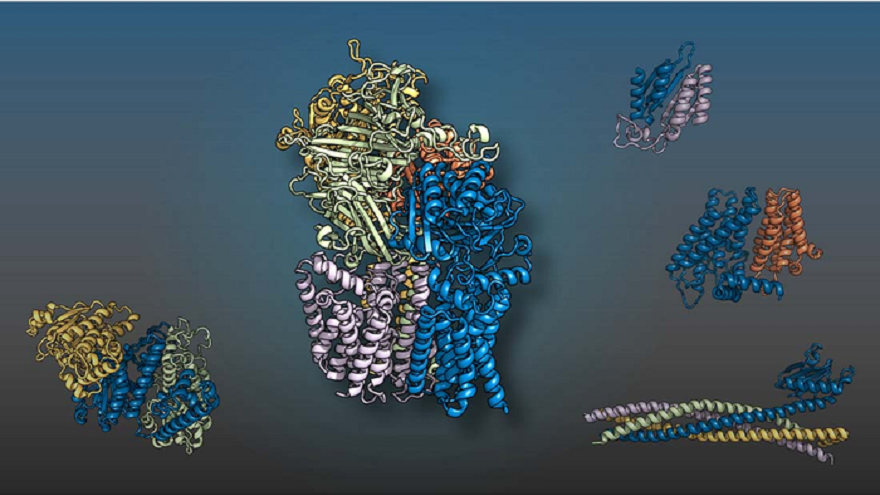
《Science》AI破解百項全新蛋白質複合體結構 挖掘新藥物靶點
2021-11-18 / 記者 李林璦
近日(11日),美國德州大學西南醫學中心(UTSouthWestern)與華盛頓大學的研究人員,利用人工智慧(AI)及演化分析(evolutionaryanalysis)生成真核生物蛋白質相互作用的3D模型,首次發現了100多種蛋白質複合體結構,並提供了700多種以往無特徵蛋白質複合體的結構模型,透過深入了解蛋白質相互作用,有望挖掘到大量新的藥物靶點。該研究發表於《Science》。 該研究同時使...
11/17《生技股動態》
2021-11-17 / 財經中心
市場觀測:✔杏國(4192)SB05_EndoTAG-1抗腫瘤新藥取得澳洲專利11/17一日漲跌:(漲)藥華藥10%、順藥9.97%、美時9.68%(跌)杏國10%、生華科4.55%、龍燈-KY4.17%http://bit.ly/211117bs11/17三大法人動態(買超)台耀272張、生華科192張、麗豐-KY85張;(賣超)大江1286張、杏輝764張、太景*-KY492張http://b...
大學光(3218)受邀參加證券櫃檯買賣中心之第三季「櫃買市場業績發表會」(110/11/18)
2021-11-17 / 環球生技
本資料由(上櫃公司)3218大學光公司提供序號 1 發言日期 110/11/17 發言時間 18:06:17發言人 劉俊杰 發言人職稱 資深處長 發言人電話 2655-8000主旨 本公司受邀參加證券櫃檯買賣中心之第三季「櫃買市場業績發表會」符合條款 第 12 款 事實發生日 110/11/18說明 符合條款第四條第XX款:12事...
杏國(4192)SB05_EndoTAG-1抗腫瘤新藥取得澳洲專利
2021-11-17 / 環球生技
本資料由(上櫃公司)4192杏國公司提供序號 1 發言日期 110/11/17 發言時間 17:32:54發言人 蘇慕寰 發言人職稱 總經理 發言人電話 (02)2764-0826主旨 本公司接獲SB05_EndoTAG-1抗腫瘤新藥之澳洲專利公告通知符合條款 第 53 款 事實發生日 110/11/17說明 1.事實發生日:11...
晶宇(4131)辦理減資完成實收資本額變更登記,減資後每股淨值6.24
2021-11-17 / 環球生技
本資料由(上櫃公司)4131晶宇公司提供序號 1 發言日期 110/11/17 發言時間 17:21:20發言人 李義祥 發言人職稱 財務經理 發言人電話 037-585585#113主旨 本公司辦理減資完成實收資本額變更登記符合條款 第 36 款 事實發生日 110/11/17說明 1.主管機關核准減資日期:110/09/232...
聯亞藥(6562)董事會決議更換股務代理機構為統一證券
2021-11-17 / 環球生技
本資料由(興櫃公司)6562聯亞藥公司提供序號 2 發言日期 110/11/17 發言時間 16:08:05發言人 范瀛云 發言人職稱 行政管理中心副總經理 發言人電話 03-5977676主旨 公告本公司董事會決議更換股務代理機構事宜符合條款 第 44 款 事實發生日 110/11/17說明 1.事實發生日:110/11/172...
威健生技(6661)受邀參加兆豐證券舉辦之線上法人說明會(110/11/18)
2021-11-17 / 環球生技
本資料由(上櫃公司)6661威健生技公司提供序號 1 發言日期 110/11/17 發言時間 15:54:50發言人 陳盈任 發言人職稱 管理處副總經理 發言人電話 (02)66160001主旨 本公司受邀參加兆豐證券舉辦之線上法人說明會符合條款 第 12 款 事實發生日 110/11/18說明 符合條款第四條第XX款:12事實發...
仁新(6696)內部稽核主管異動為陳韋如
2021-11-17 / 環球生技
本資料由(興櫃公司)6696仁新公司提供序號 1 發言日期 110/11/17 發言時間 15:35:54發言人 林雨新 發言人職稱 董事長暨執行長 發言人電話 02-87805008主旨 公告本公司董事會決議通過內部稽核主管異動案符合條款 第 11 款 事實發生日 110/11/17說明 1.人員變動別(請輸入發言人、代理發言人...
創源(4160)受邀參加證券櫃檯買賣中心舉辦之線上直播「業績發表會」(110/11/18)
2021-11-17 / 環球生技
本資料由(上櫃公司)4160創源公司提供序號 1 發言日期 110/11/17 發言時間 14:49:25發言人 涂蕙蘭 發言人職稱 資深經理 發言人電話 (02)27951777主旨 公告本公司受邀參加證券櫃檯買賣中心舉辦之線上直播「業績發表會」符合條款 第 12 款 事實發生日 110/11/18說明 符合條款第四條第XX款:...
醣聯(4168)受邀參加台新證券舉辦之法人說明會(110/11/18)
2021-11-17 / 環球生技
本資料由(上櫃公司)4168醣聯公司提供序號 1 發言日期 110/11/17 發言時間 14:02:49發言人 呂耀華 發言人職稱 副總經理 發言人電話 (02)2697-4168主旨 本公司受邀參加台新證券舉辦之法人說明會符合條款 第 12 款 事實發生日 110/11/18說明 符合條款第四條第XX款:12事實發生日:110...
阿茲海默藥Aduhelm爭議之後 百健研發主管Alfred Sandrock突退休;S+N設立新機器人創新中心 促手術機器人發展
2021-11-17 / 環球生技
《臺灣》臺大醫院與越南胡志明醫藥大學震興醫院簽署交流MOU 今(17)日,臺大醫院表示,已於今年11月8日與越南胡志明醫藥大學震興醫院(UniversityMedicalShingMarkHospital),簽署交流合作備忘錄。 臺大醫院表示,越南胡志明醫藥大學震興醫院總規劃設有57個手術室、100間診間、2000個病床,醫院第一期於2017年9月建成,核備床數為300張,院內目前有約百名醫師。目...
2021-11-17生技股:(漲)藥華藥10%、順藥9.97%、美時9.68%;(跌)杏國10%、生華科4.55%、龍燈-KY4.17%
2021-11-17 / 財經中心
20211117漲幅前十名名次名稱股價(元)日漲跌幅(%)周漲跌幅(%)月漲跌幅(%)2021111620211110202110151藥華藥(6446)143.0010.0041.5859.962順藥(6535)35.859.979.4713.813美時(1795)106.509.6814.278.674逸達(6576)87.707.7413.168.145欣大健康(4198)6.466.952...