《Science》精準靶向過度活躍神經元 新基因療法降小鼠癲癇80%
2022-11-08 / 記者 劉馨香
近(4)日,英國倫敦大學學院(UniversityCollegeLondon)研究團隊開發了一種可靶向過度活躍神經元的基因療法,在局部型癲癇(focalepilepsy)小鼠模型中,平均降低癲癇發作達80%,且不影響認知能力;在人腦類器官(organoids)的測試也顯示,可抑制過度活躍的神經元。該基因療法研究成果發表在《Science》。 癲癇可分為多種類型,但它們都是由成群過度活躍的神經元刺激...
Precisis腦部電刺激微創醫材治癲癇 獲歐盟CE認證
2022-09-26 / 記者 劉馨香
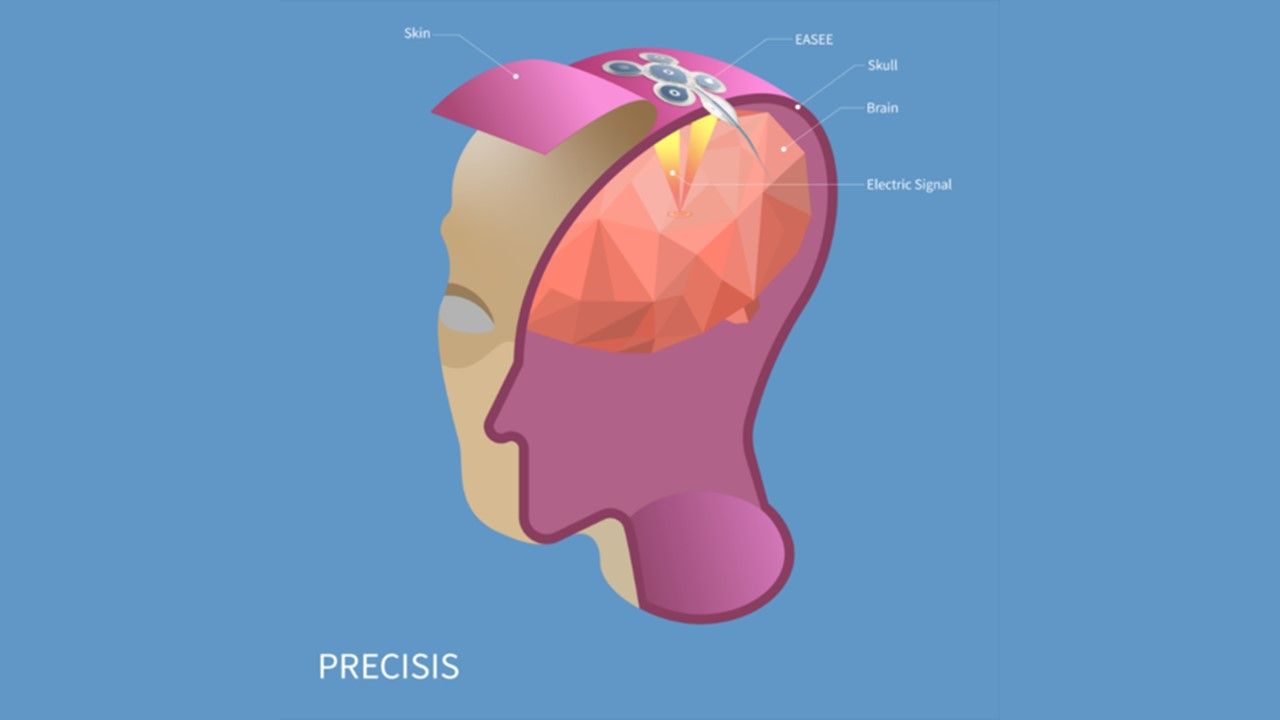
近(23)日,德國公司PrecisisGmbH宣布,其開發用於治療癲癇的微創神經刺激系統EASEE,獲得歐盟CE認證,適用於成年癲癇患者。此批准為頑固型局部癲癇(focalepilepsy)患者,帶來新的治療選項。儘管許多癲癇患者可以透過藥物治療,但大約有30%的患者療效不彰,可能需要數十年的時間,才能找到有效的替代方法,而EASEE將讓這些患者可以在早期階段就接受治療。Precisis將EASE...
易威(1799)子公司Tulex新藥(505(b)(2))液態口服劑型癲癇藥通過美專利並登錄FDA橘皮書
2022-09-22 / 環球生技
本資料由 (上櫃公司)1799易威 公司提供序號 2 發言日期 111/09/22 發言時間 15:59:08發言人 吳雪君 發言人職稱 財務協理 發言人電話 (03)666-9596主旨 代子公司美國TulexPharmaceuticalsInc.公告,共同開發新藥(505(b)(2))液態口服劑型癲癇藥品(研發代號:ET-101)通過美國發明專利並...
罕見癲癇藥終問世! Marinus首款新藥獲批 服藥一年癲癇發作降5成
2022-03-22 / 記者 巫芝岳
近(18)日,美國食品藥物管理局(FDA)宣布批准賓州生技公司MarinusPharmaceuticals的罕見癲癇新藥Ztalmy(ganaxolone),該藥物不但是「CDKL5缺乏症」(CDD)這項罕見神經發育障礙,目前獲批的第一項藥物,也是Marinus成立20年來,第一項取證的藥物。該消息雖讓Marinus股價在上週單日最高漲了30%,但外媒表示,由於投資者可能仍對該公司未來營運持懷疑態...
UCB斥資19億美元併購Zogenix 癲癇產品線再添生力軍
2022-01-21 / 記者 巫芝岳
近(19)日,比利時跨國藥廠優時比(UCB),宣布以19億美元收購美國罕病藥物開發公司Zogenix,該交易讓UBC取得Zogenix剛在2020年獲美國食品藥物管理局(FDA)批准的罕病新藥Fintepla,為其癲癇治療產品現增添生力軍,也是UCB近兩年來,為擴充癲癇產品線的第二項併購案。由於UBC自身的癲癇藥物Vimpat,是目前其唯二兩項暢銷產品之一,且預計今年3月將失去美國的獨賣權,因此這...
易威(1799)孫公司Tulex與Azurity共同開發新藥(505(b)(2))液態口服劑型癲癇藥品,接獲美FDA通知領取藥證
2021-11-09 / 環球生技
本資料由 (上櫃公司)1799易威 公司提供序號 4 發言日期 110/11/09 發言時間 13:56:02發言人 吳雪君 發言人職稱 財務協理 發言人電話 (03)666-9596主旨 代孫公司美國TulexPharmaceuticals公告,共同開發新藥(505(b)(2))液態口服劑型癲癇藥品,接獲美國FDA通知領取藥證符合條款 第 1...
羅氏旗下Spark擲3.28億美元 增抗藥性癲癇基因療法;長期奈米銀抗菌治療恐感染復發?細菌形成生物膜增抗藥性
2021-10-13 / 環球生技
《臺灣》台睿攜手共信開發新一代口服抗癌新藥 今(13)日,台睿(6580)表示,其研發的新一代口服抗癌新藥CVM-1118,為拓展品之研發效益,已與共信醫藥(6617),簽訂一項合作協議,將共同針對CVM-1118與其他藥物合併用於非小細胞肺癌治療進行研究,並放眼中國肺癌市場的開發。 CVM-1118具有多重標靶作用機制及獨特的抑制癌細胞類管道形成(Vasculogenicmimicry,VM)的...
NeuroPace建癲癇監測平臺 推動遠距個人化照護;先進國家醫療整體品質排名:挪威居首、美國墊底
2021-08-05 / 環球生技
《臺灣》順藥急性缺血性腦中風新藥外媒估搶佔羅氏14億美元市場順天醫藥(6535)3日宣布其急性缺血性腦中風新藥LT3001,在小型臨床2a期試驗沒有增加嚴重腦出血的風險。美國時間4日,外媒《FierceBiotech》分析指出,此試驗結果顯示順藥有望與全球25大製藥公司百健(Biogen)競爭,搶佔羅氏(Roche)擁有的14億美元市場。 《臺灣、日本》保瑞藥業與日本共和製藥簽訂代工合作 今(5)...
癲癇治療福音!林口長庚引進機器手臂輔助系統 傷口更小、下刀更精準
2021-04-12 / 記者 吳培安
今(12)日,林口長庚紀念醫院神經外科、腦功能暨癲癇科,介紹ROSA機器手臂輔助系統及目前應用在癲癇的成果。院方表示,自去(2020)年引進ROSA機器手臂輔助系統,目前已完成7例腦部癲癇手術,術後有2位達成癲癇零發作、3位僅剩輕微症狀,其餘2位癲癇發作頻率已減少一半以上,達到有效消弭癲癇的治療目標。 林口長庚醫院說明,透過新式ROSA機器手臂輔助系統,醫師可將患者的腦部影像先匯入專用主機及作業系...
武田8.56億美元買回Ovid罕病癲癇藥 望增罕病治療業務
2021-03-05 / 記者 巫芝岳
近(4)日,武田(Takeda)宣布以8.56億美元價格,買回其先前與美國生技公司OvidTherapeutics共同開發的罕見疾病癲癇藥物soticlestat(TAK-935/OV935)全數開發與商業化權利。該藥物已在二期臨床試驗顯示,能顯著降低罕病卓飛症候群(Dravetsyndrome,DS)和雷葛氏症候群(Lennox-Gastautsyndrome,LGS)患者的癲癇發作。該交易預計...
易威(1799)孫公司與Eton Pharmaceuticals開發之505(b)(2)口服溶劑型癲癇藥,向美國FDA提出NDA(補充Eton背景)
2020-10-08 / 環球生技
本資料由 (上櫃公司)1799易威 公司提供序號3發言日期109/10/08發言時間17:13:10發言人吳雪君發言人職稱財務協理發言人電話(03)666-9596主旨代孫公司美國TulexPharmaceuticals,Inc.公告,與EtonPharmaceuticals共同開發505(b)(2)口服溶劑型癲癇藥品,已向美國FDA提出新劑型新藥查驗登記申請(NDA)(補充說明Eton公司資訊)...
武田/Ovid新藥臨床2期成果積極 降低癲癇發作34%
2020-08-26 / 記者 李林璦
美國時間25日,武田(Takeda)與OvidTherapeutics共同研發的癲癇藥soticlestat,其臨床2期數據顯示,有助於減少罕見遺傳性癲癇患者的發作頻率,且治療卓飛症候群(DravetSyndrome,DS)的效果優於雷葛氏症候群(Lennox-Gastautsyndrome,LGS),因此未來也將進行卓飛症候群的臨床3期試驗。 該臨床2期試驗稱為OV935或TAK-935,共納入...