逸達前列腺癌新劑型新藥 Camcevi®美國市場授權 Intas 總權利金破2億美元
2021-03-05 / 記者 劉端雅
昨(4)日,逸達生技(6576)與IntasPharmaceuticals共同宣佈簽訂逸達研發之柳菩林前列腺癌新劑型新藥Camcevi®(即FP-0016個月及3個月劑型)美國市場獨家授權經銷合約,總授權金額最高可達2億700萬美元。 逸達表示,目前Camcevi®42毫克(六個月劑型)於美國的新藥註冊申請(NDA)正在審查階段,預計在今年年中左右取得美國FDA之審查意見。 根...
交易額上看42億美元! 輝瑞攜手Myovant 共推首款晚期前列腺癌口服藥
2020-12-29 / 記者 巫芝岳
編譯/巫芝岳美國時間24日,輝瑞(Pfizer)和開發內分泌疾病療法的MyovantSciences共同宣布,兩公司將合作開發Myovant日前剛獲美國FDA批准的第一款晚期前列腺癌口服藥ORGOVYX(relugolix)。包含前期付款與後續里程碑金,Myovant最多將獲得42億美元,消息宣布後該公司當日股價最大漲幅達32%。根據協議,兩公司將從明(2021)年初開始,共同合作ORGOVYX在...
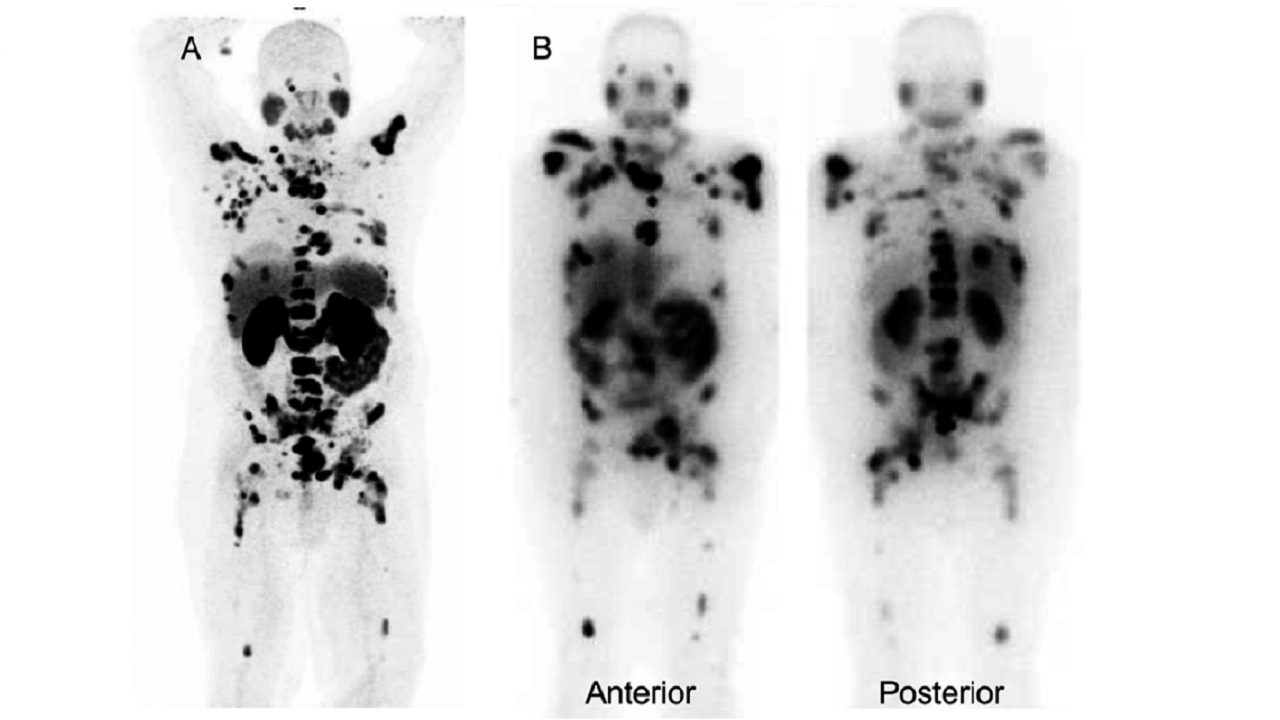
前列腺癌轉移診斷大躍進! FDA批准首款前列腺特異膜抗原PET示蹤劑
2020-12-02 / 記者 彭梓涵
編譯/彭梓涵 美國時間(1)日,美國食品藥物管理局(FDA)宣布,批准加州大學洛杉磯分校和舊金山分校聯合開發的鎵68PSMA-11(Gallium68PSMA-11)。該產品是FDA首個批准針對前列腺癌男性患者前列腺特異膜抗原(PSMA)陽性病灶的正子斷層造影(PET)示蹤劑(Radioactivetracer),可用於前列腺癌疑似與轉移患者診斷。 Ga68PSMA-11的批准是根據兩項前瞻性臨床...
安斯泰來推出Xtandi新劑型 並前進前列腺癌早期控制
2018-06-15 / 記者 徐淨
安斯泰來(Astellas)於近(13)日宣佈,在日本推出2種規格的Xtandi(enzalutamide)片劑(40mg和80mg),用於治療去勢抵抗性前列腺癌(Castration-ResistantProstateCancer,CRPC)。該產品的上市,為患者提供了更友善的劑型選擇。截止2018年5月為止,Xtandi已在全球70多個市場銷售。2014年5月,日本市場上僅有40mg膠囊選擇,...
逸達FP-001三個月劑型 獲美FDA批准展開三期臨床
2017-07-17 / 記者 蔡立勳
逸達生技(6576)宣佈,旗下前列腺癌新劑型新藥FP-001三個月劑型(25mg),於美東時間7月14日取得美國FDA的人體三期臨床試驗核准。逸達指出,此次試驗將省略一、二期,直接執行一個開放標籤、無對照組,針對柳菩林25mg三個月施打一針於前列腺癌患者的療效、安全性、及藥物動力學的三期臨床試驗,並儘快開始在美、歐、亞的5國19個據點收錄FP-001三個月劑型的受試者。此外,逸達旗下治療氣喘的Fi...
逸達前列腺癌新劑型新藥 三期臨床主要療效指標亮眼
2017-01-17 / 環球生技
逸達生技(6576)於16日宣布,已完成首項產品,以前列腺癌為適應症的FP-001LMIS50毫克(6個月劑型)三期臨床實驗數據分析,主要療效指標高達受試者的97%。逸達指出,此開放標籤、無對照組的實驗耗時兩年,經過6次期中分析,137名患者分布在美國、歐洲6國與台灣,共30個據點。此次試驗主要療效指標,是於初次使用FP-001LMIS50毫克6個月緩釋針劑後28天內,血清睪酮含量下降至未超過50...
逸達前列腺癌用藥 今年Q4完成三期臨床
2016-04-13 / 記者 蔡立勳
逸達生技(6576)於4月12日以每股參考價115元登錄興櫃,董事長簡銘達表示,旗下緩釋藥物輸送平台(SIF)目前已取得8項專利,以此平台開發的前列腺癌用藥FP-001在台灣、美國及歐盟等16國30個中心進行臨床試驗,預計於今年第四季完成三期臨床,於明年下半年提出藥證申請。目前北美及歐洲地區已分別有6家、3家藥廠與逸達接洽FP-001授權事宜,未來也將積極佈局醫療服務市場開始快速成長的新興國家。簡...

.jpg)