逸達Camcevi六個月劑型10月美國市場銷售量創新高 合併營收新台幣2,515萬元
2025-11-11 / 新聞中心
逸達生技(6576)昨(10)日公告10月合併營收約新台幣2,515萬元,較上個月增加296.7%;累計今年1-10月合併營收約新台幣4.04億元,相較去年同期新台幣3.94億元,年增2.6%。本月合併營收包含供貨CAMCEVI六個月劑型予授權夥伴之銷貨收入新台幣1,311萬元,以及CAMCEVI六個月劑型美國終端市場之銷售分潤1,204萬元。 用於治療晚期前列腺癌CAMCEVI六個月劑型10月在...
逸達前列腺癌新劑型新藥獲以色列藥證
2024-07-11 / 記者 巫芝岳
昨(10)日晚間,逸達(6576)公告其前列腺癌新劑型新藥Camcevi42毫克(六個月緩釋注射劑,即FP-00150毫克),取得以色列上市許可,用於治療晚期前列腺癌。逸達表示,本次由授權夥伴Megapharm協助送件申請,未來也將由Megapharm負責以色列行銷。 逸達表示,Camcevi為預充填式緩釋針劑,是以其緩釋針劑平台技術開發而成,盼改善過去30年來,適用於多項癌症的高活性Leupli...
羅氏、Exelixis前列腺癌聯合免疫療法三期臨床樂觀 預備尋求FDA批准
2023-08-22 / 記者 巫芝岳
美國時間21日,羅氏(Roche)與Exelixis宣布,其前列腺癌組合療法Tecentriq(atezolizumab)+Cabometyx(cabozantinib)的關鍵臨床三期試驗CONTACT-02,達到了一項主要臨床終點,該療法可顯著降低患者無惡化存活期(PFS),雖目前初步分析在總存活期(OS)方面未達到統計顯著性、僅顯示有「改善趨勢」,但Exelixis和另一合作夥伴Ipsen仍計...
AZ癌藥Lynparza再獲前列腺癌批准!撤發炎性腸道疾病二項臨床
2023-06-02 / 記者 吳培安
美國時間1日,美國食品藥物管理局(FDA)宣布批准阿斯特捷利康(AZ)及默沙東(MSD)的Lynparza(olaparib),搭配類固醇組合abiraterone+prednisone或腎上腺皮質酮,用於轉移性去勢抗性前列腺癌(mCRPC)治療;同日,AZ也宣布終止brazikumab在發炎性腸道疾病(IBD)的臨床開發計畫,包括克隆氏症(Crohn’sdisease)和潰瘍性結腸炎...
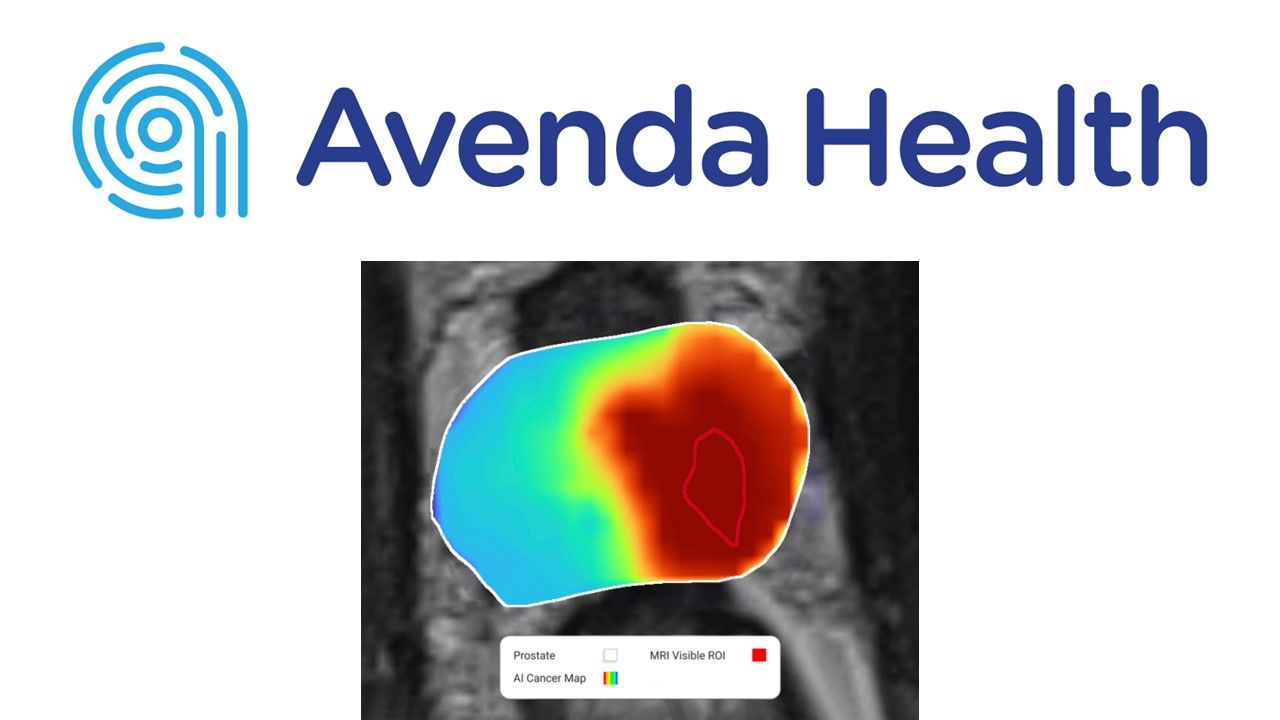
前列腺癌不須全切除?! 美FDA批准精準定位AI 實現局部治療
2022-12-09 / 記者 劉馨香
7日,美國醫療AI公司AvendaHealth宣布,其精準定位前列腺癌位置的AI輔助軟體iQuest,已獲得美國食品藥物管理局(FDA)510(k)批准,有助於實現個人化的前列腺癌治療。AvendaHealth表示,iQuest可協助醫師分割磁振造影(MRI)特徵、評估病變,並規劃手術和活體組織檢查(biopsy)。該系統以深度學習演算法,建構出「量身定做的3D地圖」,顯示前列腺中的癌症位置,以讓...
逸達前列腺癌新藥 再獲歐洲核准上市
2022-05-31 / 記者 劉馨香
今(31)日,逸達生技(6576)宣布,其前列腺癌新藥CAMCEVI42毫克(即FP-00150毫克),通過歐洲藥品管理局(EMA)上市許可申請(MarketingAuthorizationApplication,MAA),該上市許可適用於所有27個歐盟成員國,及冰島、挪威以及列支敦士登等國。逸達表示,CAMCEVI歐洲市場之行銷將由逸達的合作夥伴AccordHealthcare負責。CAMCEV...
逸達前列腺癌新劑型新藥 獲歐盟⼈體⽤藥委員會建議許可上市
2022-03-25 / 記者 劉馨香
昨(24)日,逸達公告其柳菩林前列腺癌新劑型新藥CAMCEVI42mg六個月緩釋劑型(即FP-00150毫克),獲得歐洲藥品管理局(EuropeanMedicinesAgency,EMA)所屬之歐盟人體用藥委員會(CHMP)正面意見,建議給予上市許可;歐洲委員會(EuropeanCommission,EC)將審查該CHMP建議,並預計在約2個月後做出最終決定。若獲得批准,將由逸達的合作夥伴Acco...
《The Lancet Oncology》MRI結合血液檢測新技術 減少前列腺癌過度診斷
2021-08-17 / 實習記者 蕭宇軒
近(12)日,瑞典卡羅林斯卡學院(KarolinskaInstitute)研究團隊發表一項研究。該研究表明,使用核磁共振成像(MRI)結合一種新型血液檢測稱作theStockholm-3test(STHLM3),能將前列腺癌篩檢的MRI次數減少三分之一,進一步避免檢測到低風險腫瘤。該研究刊登於《TheLancetOncology》。 先前研究已說明,MRI可以減少過度診斷,改善前列腺癌篩檢。而研究...
諾華前列腺癌「精準」放療 三期試驗告捷 存活期延長4個月
2021-07-12 / 記者 巫芝岳
近(10)日,在2021歐洲泌尿外科學會年會(EAU21)中,諾華(Novartis)發表了其前列腺癌創新「精準」放射療法「Lu-PSMA-617」的最新臨床三期試驗結果,比起標準治療,併用這種精準靶向腫瘤特定抗原的放射治療,可顯著延長患者平均存活期4個月。該項名為VISION的研究,在2018年6月至2019年10月間,招募了831名轉移性去勢抗性前列腺癌(castration-resistan...





.jpg)


.jpg)