CGT法規監管挑戰複雜!專家建議:與法規監管單位對話越早越好!
2025-12-16 / 記者 彭梓涵
由經濟部產業技術司指導、資策會科技法律研究所主辦的「國際法規線上論壇」,聚焦於細胞與基因治療(CGT)的法規監管挑戰、現況與最新發展,分別於9月26日、10月29日舉辦兩場活動,邀請到AlanLiss、IraKrefting兩位曾任職美國FDA的法規監管專家,以及SparkTherapeutics前法規與政策內容管理主管、現任BIO科學法規事務副總裁SnehalNaik,透過專題演講、綜合討論,為...
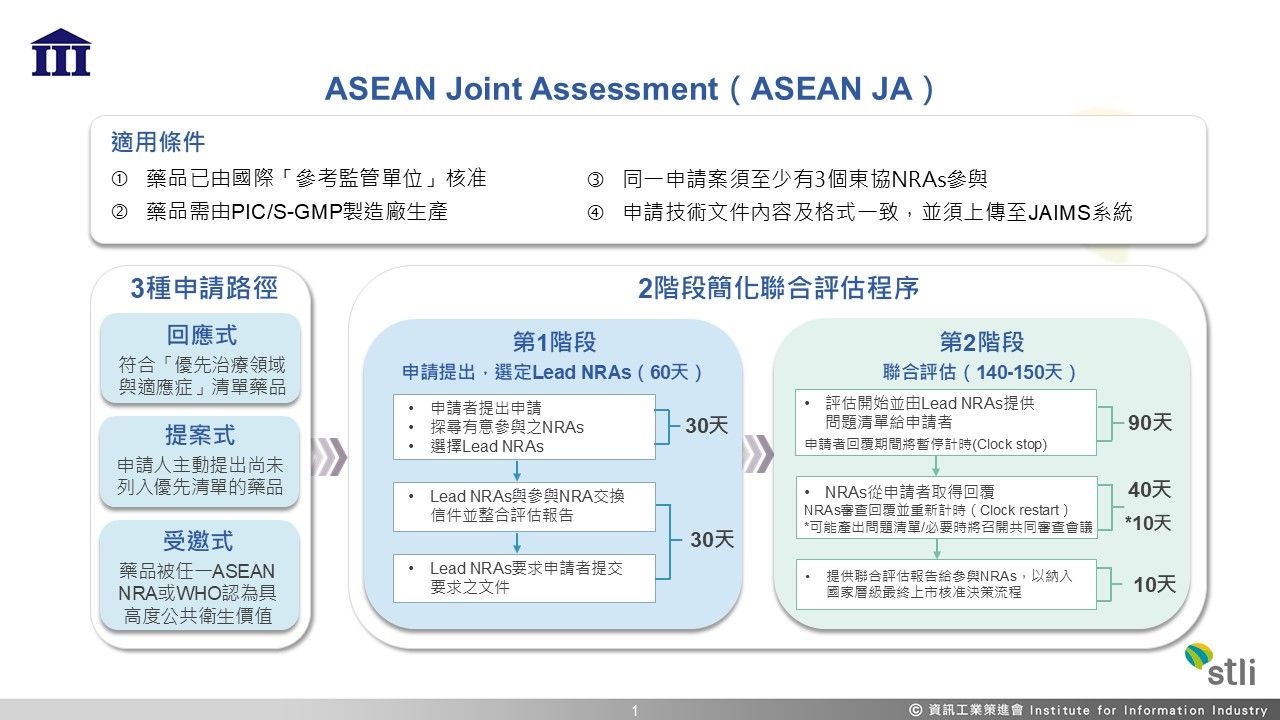
東協區域聯合評估機制助降低藥品跨國上市重複審查成本及時間
2025-12-02 / 資策會科法所
製藥公司在拓展海外市場往往面臨各國單獨審查、資源分散、上市申請審查時間冗長等挑戰,可能導致錯過搶占市場之先機。東協聯合評估(ASEANJointAssessment,ASEANJA)接受同一藥品可同時提交至少3個參與東協會員國藥品監管單位(NationalRegulatoryAuthorities,NRAs)之上市審查申請,由各NRAs國聯合評估並產出聯合評估報告,再由各國監管單位依該國程序做出最...
CGT法規監管變動快!專家:與監管機構早期溝通至關重要
2025-11-06 / 記者 吳培安
10月29日,由經濟部產業技術司指導、資策會科技法律研究所主辦的「國際法規線上論壇:美國細胞與基因治療(CGT)產品的法規框架—現況與新發展」,第二場邀請到SparkTherapeutics前法規與政策內容管理主管、現任生物創新組織(BIO)科學法規事務副總裁SnehalNaik,並於綜合討論中,與擁有豐富藥物法規策略與臨床經驗的洪筱玲博士對談,分析當前美國CGT監管動態,也提醒台灣...
專利制度對於創新與藥價可近性的兩難 資策會科法所匯聚法學專家 傳授風險控管心法
2025-10-22 / 記者 彭梓涵
2025年10月15日,由經濟部產業技術司指導、資策會科技法律研究所舉辦的「2025癌症健康治理及專利實務工作坊」,第二場「國際關鍵疾病藥物專利實務」場次,邀請台大法律學院李素華教授、萬國法律事務所呂紹凡律師、寰瀛法律事務所蘇佑倫律師、理律法律事務所黃裕煦專利師與北美智權集團劉家豪專利師、資策會科法所張羽筑副研究員,從法律、政策與產業實務三面向,共探專利制度如何支撐新藥研發、確保創新與藥價可近性的...
日本續推生物相似藥國產化政策 厚勞省再編5.7億日圓補助製造設施
2025-10-21 / 記者 彭梓涵
作者/資策會科技法律研究所跨域整合中心生醫衛政組黃毓瑩組長責任編輯:彭梓涵 日前國內生物相似藥開發業者重訊宣布,其開發的生物相似藥產品在臨床三期試驗豁免會議上獲得歐美監管單位支持,顯示歐美對該領域臨床評估的態度出現更具彈性的轉變。隨著各國積極推動生物相似藥發展,近日,日本厚生勞動省(MHLW)於10月12日發布《2026年度預算要求摘要》,在延續2024年編列65億日圓推動日本生物相似藥製造設施建...
美國《生物安全法案》修法!受關注中企名單再翻新、縮小生技設備服務範圍
2025-10-21 / 記者 吳培安
作者/資策會科技法律研究所陳怡錦法律研究員 責任編輯/吳培安 2025年10月9日,美國參議院再次修訂《生物安全法案》(BIOSECUREAct),並投票贊成將更新版本納入《國防授權法案》(NationalDefenseAuthorizationAct,NDAA)的修正案,添加到年度國防立法中。此法將會為中國與美國的生物科技產業合作帶來什麼影響?以下帶您快速了解此次修法變動的重點觀察。 《生物安全...
資策會科法所聚焦支付、法制、AI 跨界對話助產業接軌國際
2025-10-02 / 記者 李林璦
8月13日,由經濟部產業技術司指導、財團法人資訊工業策進會科技法律研究所主辦「先進醫療產品前瞻法制研討會」盛大舉行,以「先進藥品創新支付機制」、「先進醫療藥品法制趨勢」、「AI/數位化應用於藥品開發及臨床應用」三大主題,集結生醫領域政府與產業超過二十位代表齊聚一堂,並吸引逾百位產業菁英,共同交流法制與法遵議題,帶動國內產業加速調整策略、銜接國際趨勢,同時強化臺灣法政環境,讓法規成為科技發展的助力,...
專利不是唯一武器!資策會科法所解析「營業秘密」攻防關鍵
2025-09-30 / 記者 彭梓涵
9月19日,由經濟部產業技術司指導、財團法人資策會科技法律研究所主辦、台灣生物產業發展協會執行的生醫產業法制工作坊,第二場以「生醫產業營業秘密管理風險與實務案例研討」為主題,特別邀請到資策會科法所創意智財中心副主任施品安、創意智財中心專案經理林柳岑,從實務經驗出發並強調,專利並非唯一的保護方式,營業秘密同樣是企業維持競爭優勢的關鍵,企業需掌握「秘密性、價值性與合理保護措施」三要件,並建立風險分級與...
資策會科法所攜手世博 拆解生醫專利布局、透視授權/併購關鍵風險
2025-09-30 / 記者 李林璦
9月19日,由經濟部產業技術司指導、財團法人資策會科技法律研究所主辦、台灣生物產業發展協會執行的生醫產業法制工作坊,首場以「國際藥品專利授權與布局及盡職調查實務」為主題,特別邀請到具有生物醫藥背景的世博科技顧問副總經理鄒昀廷、分析師陳逸霖,詳細解析生醫領域的專利布局與併購/授權時進行盡職調查(DD)的關鍵,強化台灣生醫產業在專利智財上的防禦力與提升國際授權潛力。 資策會科技法律研究所跨域整合中心生...