索元難治型憂鬱症藥物臨床二期告捷 6週顯著改善病情
2024-04-12 / 記者 巫芝岳
近(8)日,中國生技公司索元生物(Denovo Biopharma)宣布,其憂鬱症藥物DB104(liafensine)在一項臨床2b期試驗中成功,該藥物能讓帶有特定DNA生物標記(biomarker)的難治型憂鬱症(TRD)患者病情顯著改善。該項名為ENLIGHTEN的臨床試驗,為一項隨機、雙盲,具安慰劑對照的多中心2b期試驗,共納入197名難治型憂鬱症患者。該臨床試驗透過索元生物的DGM生物標...
《Nature》藥物控釋材料大革新! 機械力觸發「輪烷」突破釋放分子數量限制
2024-04-12 / 記者 巫芝岳
近(10)日,英國曼徹斯特大學(UniversityofManchester)的科學家,開發出一項運用力學控制小分子釋放的藥物遞送技術,成為藥物控制釋放技術中,罕見僅運用機械力就能觸發,且能反覆被活化,突破可釋放分子數量限制的技術。該研究發表於頂尖期刊《Nature》。這項革命性的新技術,可在機械力的作用下(如受傷或受損部位中產生的機械力),觸發釋放藥物分子,讓治療作用部位更為精準。該技術使用一項...
諾和諾德、國內iPSC專家曝:iPSC應用潛力廣 製造、效價分析待完善
2024-04-10 / 記者 巫芝岳
今(10)日,由昱星生技和台灣醫界聯盟基金會主辦的「iPSC的潛力與應用座談會」中,諾和諾德(NovoNordisk)醫學總監MatthewDaniels、醫界聯盟執行長林世嘉、昱星執行長張郁芬,以及安美睿生技營運長何佳樺,分享了誘導型多潛能幹細胞(iPSC)和再生醫學領域的最新趨勢,以及製造和法規層面等挑戰。諾和諾德MatthewDaniels:全球大廠紛投入iPSC應用製造、效價分析待完善諾和...
義大利MMI手術機器人取FDA批准;台灣炳碩、鈦隼為先鋒
2024-04-10 / 記者 巫芝岳
近(9)日,義大利醫材公司MedicalMicroinstruments(MMI)繼今年初剛完成1.1億美元募資後,宣布其外科顯微手術機器人系統,取得美國食品藥物管理局(FDA)的創新醫材(DeNovo)批准。台灣也有如炳碩生醫、鈦隼生技等公司專注於手術機器人的公司,並皆有產品已取得台灣食藥署(TFDA)核准上市。MMI的該儀器名為Symani,能複製外科醫師雙手的動作,且動作範圍再縮小、移動地更...
竟天帶狀疱疹後神經痛新藥 臨床二期獲TFDA核准執行
2024-04-09 / 記者 巫芝岳
今(9)日,竟天生物科技(6917)公告,旗下緩解頭頸部帶狀疱疹後神經痛新藥APC101,獲台灣衛福部食藥署(TFDA)核准執行二期臨床試驗,將在三總與高醫啟動收案,評估其安全性與療效。該藥也已完成澳洲二期臨床前期試驗,整體臨床成果優異,但因人數較少,仍缺指標意義。本次為一項隨機分派、雙盲、安慰劑對照的二期臨床試驗,預計召收21位病患,藉由數字疼痛評估量表(NRS-11)評估每天兩次使用APC10...
再生元抗體藥遭拒批 FDA腫瘤學主任Richard Pazdur釋疑:驗證性試驗仍為必要!
2024-04-09 / 記者 巫芝岳
近(8)日,在2024美國癌症研究協會(AACR)年會中,美國食品藥物管理局(FDA)腫瘤卓越中心(OCE)主任RichardPazdur在「爐邊談話」活動上,談及了其先前拒絕加速批准再生元(Regeneron)淋巴瘤雙特異性抗體藥的決定因素,並強調驗證性試驗(confirmatorytrail)的必要性、多項FDA在腫瘤學領域的推行計劃,以及諮詢委員會改革議題。2023年間,FDA旗下的OCE共...
嬌生131億美元收購「血管震波碎石術」開創者Shockwave;全球首次「基因工程豬腎」移植! 患者已順利出院;Prenosis敗血症監測AI獲FDA批准;中醫大附醫智慧醫院再升級 獲國際高規資安雙認
2024-04-08 / 記者 巫芝岳
《臺灣》臺大醫院倫理中心揭牌 近(3)日,臺大醫院倫理中心(NTUHEthicsCenter)舉行揭牌典禮;該中心2023年3月1日成立,為臺大醫院正式一級單位,中心包含研究倫理組、臨床倫理組、及研究誠信組三個組別。本次揭牌儀式所在空間,曾一度為疫病門診所使用,疫情減緩後門診已結束,由倫理中心重新搬遷進駐,負責研究倫理、臨床倫理及學術誠信等相關業務。 《臺灣》中醫大附醫智慧醫院再升級獲國際高規資安...
《Science Advances》衛采、Ipsen兩血癌藥併用 對大腸癌更有效!?
2024-04-08 / 記者 巫芝岳
近日(3月27日),美國密西根范安德爾研究所(VanAndelInstitute)的團隊研究發現,將表觀遺傳藥物decitabine和EZH2抑制劑tazemetostat併用下,可對大腸直腸癌產生更優於單用任一藥物的療效,這兩項藥物分別是由衛采(Eisai)和Ipsen所開發,且都已獲美國食品藥物管理局(FDA)批准用於治療血癌,但未取得大腸直腸癌的適應症。該研究發表於期刊《ScienceAdv...
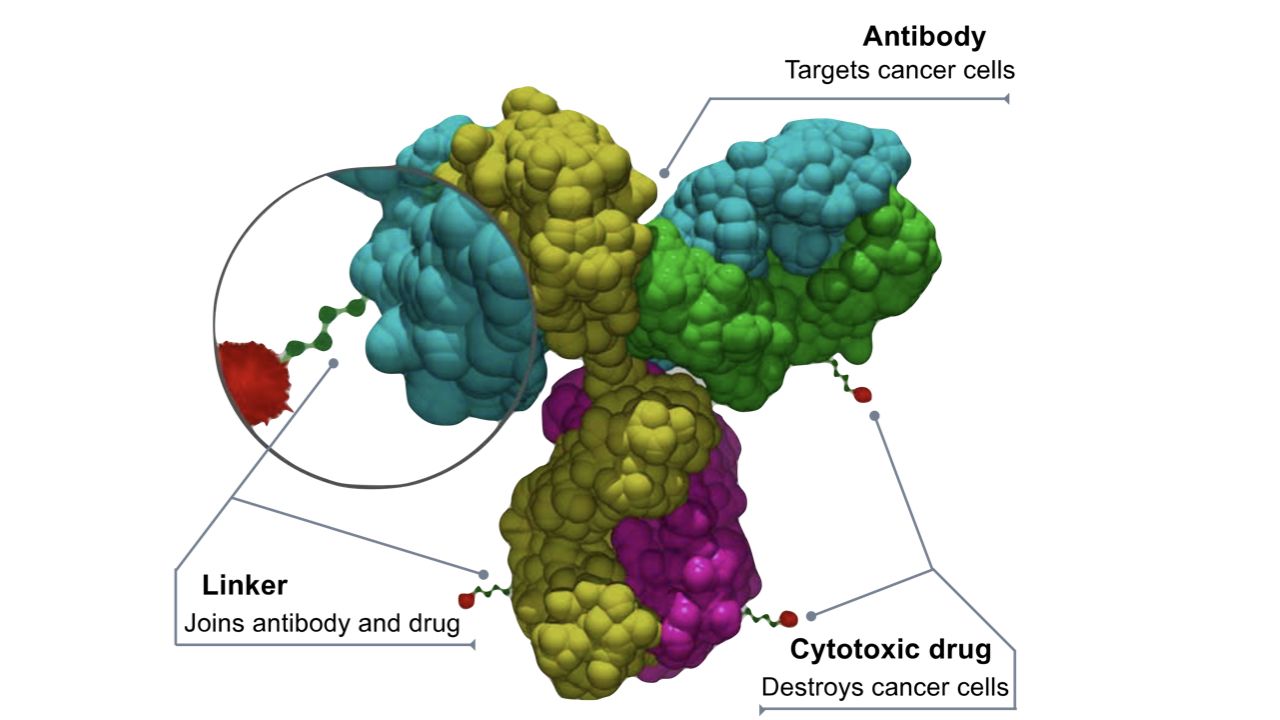
Ipsen斥9億美元取Sutro臨床前ADC藥物 攻實體、血液瘤皆具潛力!
2024-04-03 / 記者 巫芝岳
近(2)日,法商益普生(Ipsen)宣布以高達9億美元的價格,取得美國生技公司SutroBiopharma的臨床前階段抗體藥物複合體(ADC)STRO-003全球權利,成為Ipsen旗下第一款ADC候選藥物,也為近年熱門的ADC領域,再添一樁大型交易案。根據協議,Ipsen將負責STRO-003的臨床一期準備事項,包含提交新藥臨床試驗(IND)申請,和後續臨床研究及全球商業化開發。Sutro則將先...
啟新旗下台美檢驗攜手環虹錕騰 拓食品檢驗市場
2024-04-01 / 記者 巫芝岳
今(1)日,啟新生技宣布,旗下「台美檢驗」與食品檢驗公司「環虹錕騰」啟動業務合作計畫,透過兩家第三方檢驗機構,聯手拓展全台北中南檢驗服務市場。啟新也已規劃於2025年申請公發興櫃,期望整合產業上下游資源鏈擴大經營。啟新表示,台美檢驗是專注生技醫藥的第三方檢驗機構,擁有數千種的檢測項目和完整的認證項目,可以進行檢驗分析以及委託研究,並在生技醫藥領域具有豐富的執行經驗,能提供客製化試驗服務、接受供應商...
竟天兩大新藥臨床進度佳 啟動IPO規劃最快今年底送件
2024-03-29 / 記者 巫芝岳
今(29)日,竟天生物科技(6917)董事會通過去(2023)年財務報告。因旗下新藥尚處於研發與臨床試驗階段,學名藥銷售尚未顯現規模經濟,致使去年仍為虧損,每股虧損1.87元。正在臨床階段的APC101、APC201新藥進展順利,竟天將啟動IPO規劃,預計最快年底前送件申請上櫃。 竟天表示,目前緩解帶狀疱疹後神經痛噴霧新藥APC101、骨關節炎局部疼痛泡沫劑新藥APC201的臨床試驗進展順利,近期...
原創生醫登興櫃 主打「首家軍工生醫股」
2024-03-29 / 記者 巫芝岳
今(29)日,原創生醫(6483)以每股參考價20元登興櫃,主打多項505(b)(2)新藥研發,包括:預防/治療火災吸入氰化物中毒的OBM-B01,和預防/治療輻射傷害的OBM-A01等。多項產品可望經由美國食品藥物管理局(FDA)的「動物療效原則(AnimalRule)」,以靈長類動物數據補足後期臨床,加速臨床研發,預期在近兩年內上市。成立於2011年的原創,曾在2016年下興櫃,如今以多項潛力...








.jpg)