FDA、NIH攜手15家公司、非營利組織 7600萬美元資助罕病基因療法邁入臨床
2021-10-29 / 記者 李林璦
美國時間27日,美國食品藥物管理局(FDA)、美國國家衛生研究院(NIH)與10家製藥公司和5個非營利組織合作,成立了BespokeGeneTherapyConsortium(BGTC),將在5年內出資7600萬美元,資助4~6項單基因罕病臨床試驗,目標為優化、簡化與加速罕見疾病基因療法的開發流程,幫助填補罕病領域中未滿足的醫療需求。 BGTC的成立目的是增加對腺相關病毒(adeno-associ...
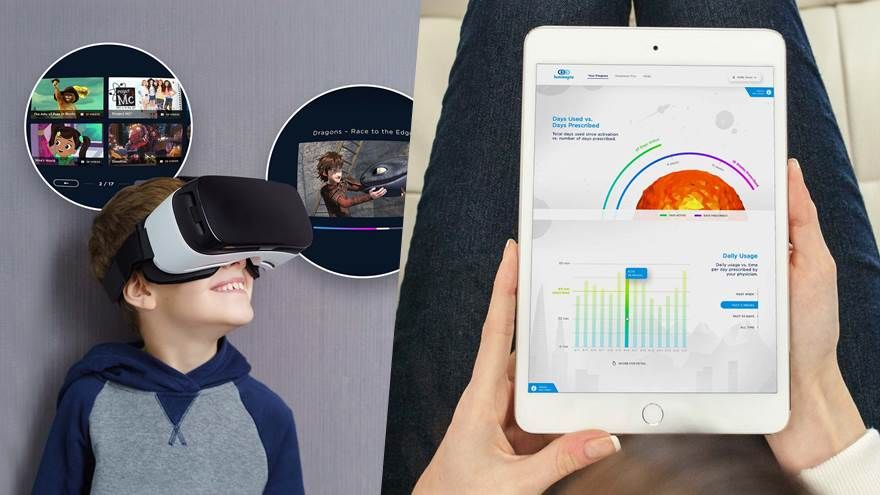
FDA首批!VR眼鏡數位療法 看影片治兒童弱視
2021-10-22 / 記者 李林璦
美國時間21日,美國食品藥物管理局(FDA)首批Luminopia的創新數位療法LuminopiaOne,利用虛擬實境(VR)眼鏡來治療4-7歲患有兩眼不等視(anisometropia)或輕度斜視(strabismus)的弱視兒童。這是FDA批准的第一個治療弱視(amblyopia)兒童的數位療法,也是第一個治療神經視覺障礙的數位療法。 Luminopia與波士頓兒童醫院、美國麻省理工學院皮考爾...
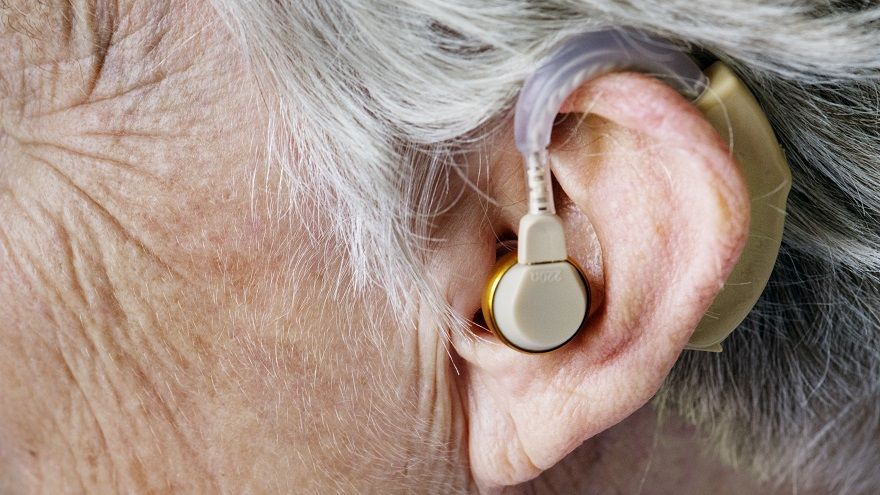
FDA里程碑法案! 擬新增「非處方籤助聽器」規範 商店、網路即可購買
2021-10-21 / 記者 李林璦
美國時間19日,美國食品藥物管理局(FDA)發布了一項極具里程碑意義的提案─將建立一個不須處方籤(OTC)助聽器的新類別,若獲通過,這類型的助聽器可不需經過聽力檢查與驗配,直接在商店或網路上購買,有助於讓數百萬美國人更廣泛的獲得助聽器。 這項舉措是因應總統拜登7月提出的「促進美國經濟之競爭」行政命令(ExecutiveOrderonPromotingCompetitionintheAmerican...
FDA推動逾60項「先進製造計畫」 全球先進製造藥物美國佔8成
2021-10-15 / 記者 彭梓涵
近(13)日,美國食品藥物管理局(FDA)表示,由於先進製造(AdvancedManufacturing)已成為全球趨勢,FDA除了2014年成立部門並推動60多項品製造研究項目,現也在與國際上其他監管單位合作,以率先制定關於「持續生產原料藥」和「國際醫藥法規協和會Q13」指南,現在FDA也為該指南公開徵求意見。 為確保全球「先進製造」的領先地位,美國製造業很早就倡議並推動先進製造相關的計畫。FD...
FDA局長將定案?傳拜登將提名Verily臨床法規策略長Robert Califf
2021-10-15 / 記者 李林璦
美國時間14日,據《華盛頓郵報》報導,拜登(JoeBiden)可能會提名Google姊妹公司Verily的臨床法規策略長RobertM.Califf再次擔任美國食品暨藥物管理局(FDA)局長。據傳雖然FDA局長人選尚未最終敲定,但Califf曾在歐巴馬政府時期擔任過FDA局長,因此是最有可能的人選。 目前,FDA已有9個月沒有正式局長,根據聯邦法律,拜登需要在最後期限11月15日前提名FDA的正式...
FDA最新指南:細胞療法得以「傘狀試驗」加速開發;基因療法「不同載體表現同基因」將視為同產品
2021-10-01 / 記者 巫芝岳
近日(9月30日),美國食品藥物管理局(FDA)發布了最新細胞與基因治療指南草案,除了提出細胞治療可透過「傘狀試驗」(umbrellatrial)機制,加速臨床開發速度外,也確定了基因治療中,多項療法即便使用「不同病毒載體」表現「相同基因」,在孤兒藥獨佔權(orphanexclusivity)的判定上,FDA仍會將之視為同樣產品。該草案指出,在傘狀試驗中,針對同疾病、兩種以上的細胞或基因治療,得以...
2021下半年FDA 5大重量級待批藥物:Argenx重症肌無力藥 年銷售估值30億美元居榜首
2021-09-15 / 記者 巫芝岳
近(7)日,市調公司EvaluateVantage統計出今年下半年,美國食品藥物管理局(FDA)有望批准的5大重量級藥物,以及其2026年的估計銷售額,其中銷售額估值排名榜首的為荷蘭藥廠Argenx開發的重症肌無力藥物efgartigimod,預計達30億美元。其他上榜藥物還包括:UCB乾癬藥bimekizumab、羅氏(Roche)黃斑部病變藥物faricimab、輝瑞(Pfizer)異位性皮膚...
FDA基因療法安全性會議無共識 專家籲致癌風險、肝損傷、腦毒性須更長久監測
2021-09-06 / 記者 吳培安
美國時間9月2日、3日,食品藥物管理局(FDA)召開專家小組會議,討論有關基因療法安全性的副作用事件及未來的研究規範,希望藉此減少基因療法對患者造成的風險。然而,據外媒《BiopharmaDive》報導指出,會中雖然提出了多種改善安全性的研究方法,然而最終專家們並未建議用任何方式放慢研究的腳步,也沒有為基因療法研究設定劑量上限。 細胞與基因療法諮詢企業DarkHorseConsulting創辦人暨...
FDA召開基因療法專家會議!聚焦評估AAV載體潛在肝腦毒性、致癌風險
2021-09-02 / 記者 吳培安
針對基因療法在動物試驗及人體出現的安全性風險,美國FDA將在9月2日、3日召開專家小組會議,討論為基因療法的臨床試驗設立新措施,以及受試者的後續監測,會議將聚焦在腺相關病毒(adeno-associatedvirus,AAV)作為基因療法載體的安全性,與該療法相關的肝臟、神經損傷和癌症案例,導致了一些生技公司開發中的挫折。 AAV是一種科學家廣泛研究、認為無害的病毒載體,經常肩負著將基因副本送進目...
美FDA公布新版學名藥指引草案 新增多項生物相等性研究建議
2021-08-23 / 記者 吳培安
美國時間20日,美國食品藥物監督管理局(FDA)宣布更新學名藥(genericdrugs,或稱仿製藥)指引草案,此次更新部分聚焦在包含藥動學試驗終點(pharmacokineticendpoints)的生物相等性(bioequivalence,BE)研究,在執行上的相關建議,並徵集大眾意見。 這份文件最初版本是在2013年12月公布。FDA表示,此次的更新目的,在於協助有意提出「簡易新藥申請程序」...
美專家:國會應考慮改革未來30年FDA加速批准機制 強化跨領域、跨單位審批
2021-08-18 / 記者 李林璦
近日,百健(Biogen)阿茲海默症新藥Aduhelm獲美國食品藥物管理局(FDA)批准所引發的爭議持續擴大,尤其是針對加速核准(acceleratedapproval)機制的優點與其侷限性也出現許多不同看法。曾負責成立FDA藥品審評暨研究中心(CDER)新藥和學名藥政策辦公室的KeithFlanagan認為,國會應考慮加強未來30年的加速批准機制改革。 加速核准機制是FDA於1992年發布,通常...
FDA批准人造皮膚移植物StrataGraft 治療深二度燒傷
2021-08-04 / 記者 劉端雅
近日,美國FDA批准MallinckrodtPharmaceuticals旗下的生物工程人體皮膚移植物StrataGraft,用於治療深層部分皮層燒傷(deeppartial-thicknessburns或稱深二度燒傷)。Mallinckrodt表示,美國生物醫學先進研究與開發局(BARDA)資助8,600萬美元,協助開發StrataGraft。StrataGraft由兩種人類皮膚細胞、角質細胞(...