近30年來首更新! 美FDA提新版「健康」食品營養標示
2022-09-30 / 記者 李林璦
美國時間28日,美國食品藥物管理局(FDA)提出可以在食品包裝上宣稱「健康(healthy)」的標示規則,該規則符合目前的營養科學、最新的食品營養標示以及美國人的膳食指南,並要求食品的鈉、糖含量必須保持在規定量之下,且須含有水果、蔬菜或乳製品成分。此次為自1994年來首次的健康標示更新。 新的健康標示規定要求區分不飽和脂肪與飽和脂肪,如堅果、富含omega-3的魚類以及橄欖油等都可以在包裝上標示「...
FDA「ISTAND領航計畫」接受首個申請案 支持藥物開發新工具
2022-09-12 / 記者 吳培安
美國食品藥物管理局(FDA)表示,其自2020年11月30日宣布上路、旨在鼓勵新藥開發技術的「新藥創新科學技術方法領航計畫」(ISTANDPilotProgram),在近(7)日正式接受第一個申請案。 該申請案是由IntegralMolecular公司提出,是一種將膜式蛋白質體分析陣列(membraneproteomearray),應用於生物療法(biotherapeutics)的專一性篩選,進而...
2022上半年美FDA僅批准16藥!下半年關注Amylyx、Bluebird新藥
2022-07-06 / 記者 劉馨香
回顧2022年上半年,美國食品藥物管理局(FDA)僅批准了16項新藥,其中有些是擴大先前的授權範圍,有些則可能會改變疾病治療的遊戲規則。相較於2021年全年批准50項、2020年全年批准53項,今年FDA批准數量要趕上2020與2021年,還有很長一段路要走。在這些改變遊戲規則的藥物中,禮來(EliLilly)的Mounjaro(tirzepatide)由優先審查獲得批准,用於治療成人第二型糖尿病...
BMS較勁Gilead 淋巴癌CAR-T療法躍二線治療、擴大適用範圍
2022-06-28 / 記者 吳培安
近(24)日,必治妥施貴寶(BMS)宣布其CAR-T產品Breyanzi(lisocabtagenemaraleucel),已獲得美國FDA擴大適應症批准,不只一躍成為大B細胞淋巴瘤(LBCL)的二線療法,還囊括了不適合造血幹細胞移植作為二線治療患者的治療新選項,與GileadSciences的CAR-T療法Yescarta,在淋巴瘤治療上較勁意味相當濃厚。 Breyanzi在去(2021)年2月...
PI3K抑制劑安全性疑慮! FDA撤TG淋巴癌藥證 公司股價暴跌11%
2022-06-02 / 記者 巫芝岳
近(1)日,美國食品藥物管理局(FDA)公告,已撤回對TGTherapeutics淋巴癌藥物Ukoniq(umbralisib)的批准,原因是藥物具安全性疑慮,使用該藥可能增加患者死亡風險。TG股價因此應聲大跌,單日跌幅超過11%。這項決議是基於今年2月時,FDA對該藥物的安全性調查,數據顯示服藥患者死亡風險可能增加、確定其風險大於益處。FDA撤銷藥證的同時,TG也表示其願意讓該藥從市場退出。20...
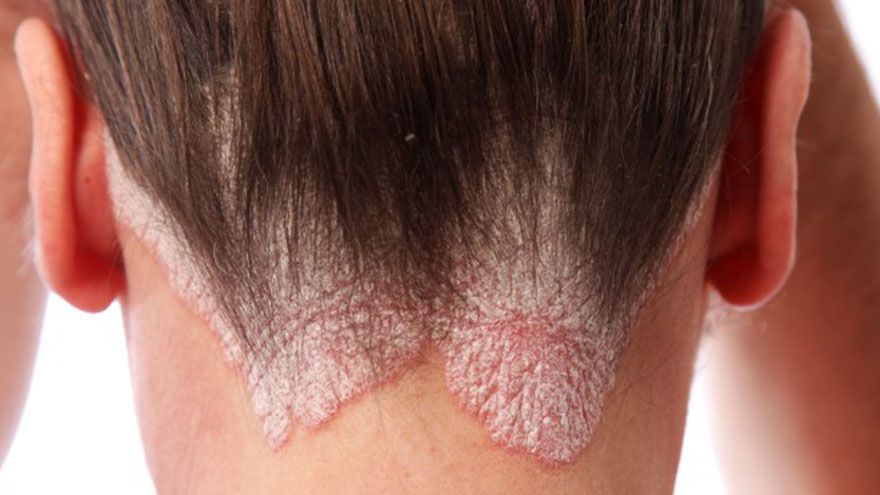
25年來首款!FDA批准非類固醇外用乾癬新藥
2022-05-25 / 記者 李林璦
美國時間24日,美國食品藥物管理局(FDA)批准DermavantSciences的1%VTAMA®(tapinarof)乳膏,用於局部治療斑塊狀乾癬(plaquepsoriasis),其為一種芳香烴受體(arylhydrocarbonreceptor,AhR)促效劑(agonist)。這是25年來FDA批准的首款乾癬外用新成份藥物(novelchemicalentities),也是同類產...
嚴防藥物供應鏈短缺! FDA提最新藥物「風險管理」指南草案
2022-05-20 / 記者 巫芝岳
近(19)日,美國食品藥物管理局(FDA)發布了最新藥物「風險管理計劃」(RMP)指引草案,用來應對藥物短缺、製造品質等相關問題。其共列舉了3類藥物,必須遵照國際醫藥法規協和會(ICH)指導原則中的風險管理規範,另7類則為「建議管理」藥物類別。該草案列舉3項需要風險管理的藥物類型,包括:1.維繫生命所需的藥物與原料藥2.用於預防或治療嚴重疾病的藥物(含緊急醫療護理或手術用藥,或突發公衛事件相關的重...
52年來首批!FDA批准Orphalan罕病威爾森氏症創新療法
2022-05-04 / 記者 李林璦
美國時間2日,法國孤兒藥公司OrphalanSA宣布,其Cuvrior™獲美國食品藥物管理局(FDA)批准用於治療對銅螯合劑鋅醋酸鹽(penicillamine)具抗藥性的威爾森氏症(Wilson'sDisease)患者,該藥物是一種創新的銅螯合劑trientinetetrahydrochloride,不僅可去除體內沉積的銅,還可以抑制腸道對銅的吸收。外媒《FiercePhar...
「PI3K抑制劑」安全性隱憂! FDA諮詢委員會將議監管是否趨嚴
2022-04-22 / 記者 巫芝岳
近日(21、22日),美國食品藥物管理局(FDA)的腫瘤藥物諮詢委員會召開會議,針對PI3K抑制劑的安全性進行討論。目前,包括Gilead、拜耳(Bayer)、SecuraBio、TGTherapeutics四家廠商,都有治療血液腫瘤的PI3K抑制劑獲批,但該四種藥物都有嚴重副作用問題,引發專家探討該類藥物的監管是否需更嚴格。據外媒表示,FDA要求諮詢委員會針對該類藥物的未來批准,「是否應基於隨機...
強化醫療器材網路安全!美FDA發布最新指南草案
2022-04-13 / 記者 劉馨香
隨著愈來愈多醫療醫材相互連結、聯網,醫療器材的網路安全(cybersecurity)變得愈來愈重要。近(8)日,美國食品藥物管理局(FDA)發布醫療器材網路安全指南草案,對於醫材涉及網路安全問題時的上市前提交內容提出建議。該指南草案正在徵詢意見至7月7日,將取代FDA在2018年發布的指南草案。 FDA在《聯邦公報》(FederalRegister)中表示,這些建議可以促進有效的上市前審查過程,並...
美FDA發布CAR-T細胞療法指南! 提供療法、CMC、臨床試驗設計建議
2022-04-07 / 記者 李林璦
日前,美國食品藥物管理局(FDA)發布嵌合抗原受體(Chimericantigenreceptor,CAR)T細胞療法開發指南草案,提供廠商包含化學、製造與管制(CMC)、藥理學與毒理學、臨床試驗設計以及針對自體或異體CAR-T細胞產品的建議。該草案正在徵詢意見至6月14日。 FDA在新發布的指南草案中,也提供進行CAR-T細胞療法比較性分析研究(comparabilitystudies)的相關建...