美FDA公告「抗癌藥劑量優化指南草案 」促最大耐受劑量改為最佳劑量;Xbrane黃斑部病變生物相似藥 獲英國MHRA上市許可
2023-01-18 / 編輯部
《臺灣》雙和醫院細胞治療中心揭牌供抗癌新選擇今(18)日,雙和醫院舉辦細胞治療中心揭牌,雙和醫院副院長暨細胞治療中心主任陳志華醫師表示,未來中心將提供多元的醫療選擇與服務,同時讓病人享有優質的治療環境,在療程中將同步整合資源與集結優秀醫療團隊,提供相關諮詢服務。 目前雙和醫院己有7件細胞治療計畫通過衛福部核准,其中有5件細胞治療計畫己通過新北市衛生局醫審會審查;9件細胞治療計畫目前衛福部審查中;4...
《Science》美國新法不要求藥物動物實驗 專家:改變仍需時間!
2023-01-14 / 記者 劉馨香
在2022年末,美國總統拜登簽署了FDA現代化法案2.0(FDAModernizationAct2.0),不再要求所有候選藥物在進入臨床試驗之前進行動物實驗。《Science》專文報導指出,此項新法受到動物福利團體的歡迎,但一些支持動物研究團體表示,改變不會太快發生。亦有專家認為,此項新法律的意義在於,開闢了替代方案是否足夠的討論空間。 1938年通過的《聯邦食品、藥品和化妝品法案》,要求以動物實...
光鼎生技年營收2.31億元創歷史新高!Qsep獲FDA上市許可 搶攻美檢測市場
2023-01-07 / 記者 彭梓涵
今(7)日,光鼎生技(6850)公告去(2022)年12月合併營收為2,949萬元,月增1.7%、年增9.6%,連續第三個月寫下新高記錄;去年全年合併營收達2.31億元,年增29.1%。光鼎生技表示,自去年10月起連續三個單月營收皆站上2,600萬元,12月營收再創新高、達2,949萬元,主要成長動能來自核心產品Qsep系列生物片段分析儀,佔總營收比重約八成,目前Qsep系列產品已銷售至全球50餘...
光鼎生技「Qsep系列生物片段分析儀」獲FDA上市許可
2023-01-06 / 記者 彭梓涵
今(6)日,光鼎生技(6850)發布重訊宣布,其開發的「Qsep系列生物片段分析儀」(QsepSeriesBio-FragmentAnalyzer)繼台灣、中國取得醫材上市許可後,再獲得美國食品藥物管理局(FDA)上市許可,目前已登錄FDAMedicalDevices數據庫,正在等待公司註冊號碼分發。Qsep系列生物片段分析儀為光鼎自主開發,其是以毛細管電泳技術和專利光學模組為核心,可提供全球用戶...
2022 FDA新藥批准回顧:總數驟減、生物製劑佔比創歷史新高(全文連結)
2023-01-04 / 記者 巫芝岳
近(3)日,據期刊《NatureReviewsDrugDiscovery》報導,美國食品藥物管理局(FDA)去年全年共批准37種新藥,相較於2021年的50種大幅減少,也低於2017年至今每年平均批准49種藥物的數量。不過回顧去年,不但在基因療法、細胞療法、疫苗等生物製劑批准上,數量明顯增加,在糖尿病、癌症等領域,也出現多款前所未見的創新機轉藥物。FDA旗下生物製劑評估及研究中心(CBER),在2...
拜登簽署逾600億美元公衛/研究資金挹注NIH、CDC、FDA
2022-12-28 / 記者 吳培安
昨(27)日,外媒報導美國總統喬‧拜登(JoeBiden)簽署了國會近日通過的1.7兆美元綜合支出法案,其中包含了共計高達602億美元的公共衛生、生醫研究經費,食品藥物管理局(FDA)、國家衛生研究院(NIH)和疾病控制及預防中心(CDC)等重要機構都受惠,經費皆超過去年同期。 FDA獲得35億美元的可自由支配資金(discretionaryfunding),比去年同期增加了2.26億美元,使得資...
FDA:抗老保健夯品NMN非膳食補充劑 以藥物審查!
2022-11-14 / 記者 李林璦
近(4)日,美國食品藥物管理局(FDA)宣布,在亞馬遜線上銷售、用於抗衰老和維持代謝功能的β-煙醯胺單核苷酸(NicotinamideMononucleotide,NMN)被排除在膳食補充劑(dietarysupplement)的定義之外,並正在將NMN做為藥物來審查。 NMN可做為合成NAD+的前驅物質,幫助調整生理機能。FDA正在審查NMN是否為一種藥物,因此,在2020年夏天至20...
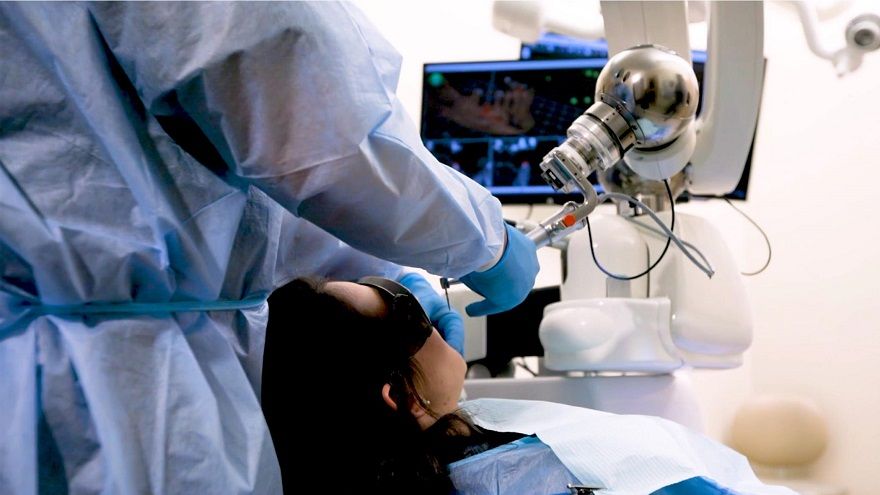
FDA唯一批准Neocis植牙手術機器人 普及全美近百地點
2022-10-19 / 記者 李林璦
手術輔助機器人已在各種外科手術領域中越來越普遍。在牙科領域中,由美國Neocis所開發的Yomi,是全球首款、也是目前唯一可用於牙科植入手術的機器人導航系統,今(2022)年6月底,FDA批准了YomiPlanGo™軟體的510(k),該產品經臨床研究證實,可改善機器人導航植牙手術的效果,且據使用醫師指出,Yomi植牙的準確率高達98.3%。 Yomi早在2017年獲得美國食品藥物管理...
FDA擲3800萬美元獎勵罕病研究 神經退化性疾病成焦點!
2022-10-18 / 記者 吳培安
美國時間17日,為了加速治療罕見疾病的醫療產品開發,美國食品藥物管理局(FDA)旗下的孤兒藥品獎勵金計畫(OrphanProductsGrantsProgram),宣布投入超過3800萬美元,給予19項新研究案和2項新合約為期4年的資金,以支持與罕見疾病相關的臨床試驗、自然發生歷程(naturalhistorystudies)和法規科學工具研究。值得注意的是,本次有多項獲得補助的研究,皆和漸凍症(...