FDA發布首份迷幻藥開發指南草案 助藥物提升安全性、有效性
2023-06-27 / 記者 彭梓涵
近(23)日,美國食品藥物管理局(FDA)首次發布迷幻藥研究的指南草案,為研究人員在開發迷幻藥(psychedelics)產品時提供研究設計、試驗進行、數據收集、受試者安全和新藥申請等建議。 迷幻藥物是改變認知與知覺的精神藥品,但這些藥物一直存在濫用的可能性,FDA為了提升藥物安全問題,決議擬定指南草案,期望透過足夠的安全措施,以防止整個臨床開發過程中的濫用。 該草案中目前對常見的迷幻藥,如:大腦...
FDA 局長Dr.Califf: 世界最好的科學,都可能因錯誤信息和文化結合而完全削弱!
2023-06-10 / 記者 王柏豪
波士頓Bio2023大會第二天(7日)重頭戲,請來二度回任的美國食品和藥物管理局局長Dr.RobertCaliff親上火線談話,在生物技術創新組織(BIO)執行長RachelKing的訪談下,針對近年來COVID的美國降低通貨膨脹法案(IRA)、藥品供應短缺、降低藥價、加速審批、以及法院對案例審查挑戰FDA權威性等熱門話題進行對話,現場座無虛席。 #covid教訓讓人們學習長期的公私合作夥伴關係#...
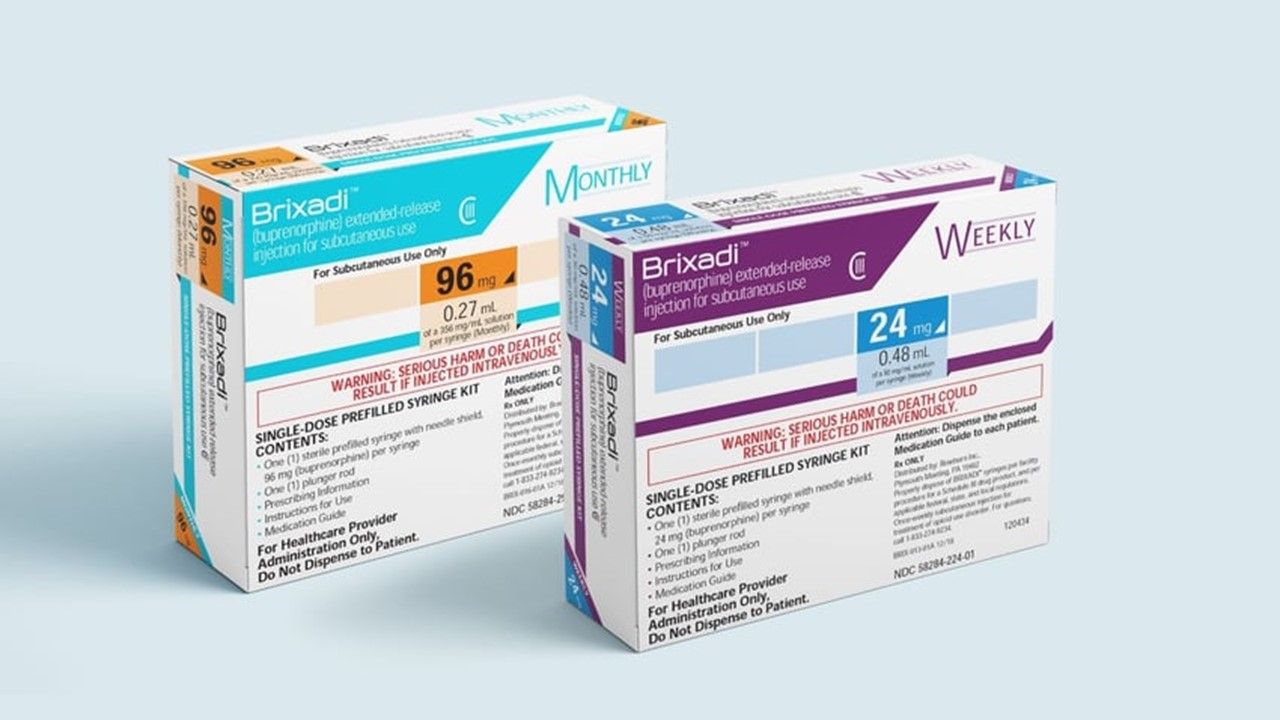
2個月3批准!FDA首批長效抗鴉片類藥物成癮療法
2023-05-25 / 記者 李林璦
美國鴉片類藥物氾濫成災,2022年因藥物濫用死亡的11萬人中,有70%與類鴉片止痛劑Fentanyl有關!美國時間24日,美國食品藥物管理局(FDA)批准Braeburn的Brixadi(buprenorphine),可透過皮下注射治療患有中度至重度鴉片類藥物成癮(opioidusedisorder)的患者。這是首款針對該適應症的長效注射劑,可選擇每周或每月給藥一次。 Brixadi的主要活性成份...
FDA即將把數位健康數據納入臨床試驗! 5大協會建議共同制定資料品質標準
2023-05-24 / 記者 李林璦
先前在3月24日時,美國食品藥物管理局(FDA)發布了在藥物與生物產品開發過程中使用數位健康技術(digitalhealthtechnologies,DHTs)的指南,並公開進行意見徵集,今(24)日,是徵集意見的截止日,至今收到包含數位醫療協會(DigitalMedicineSociety,DiMe)、國際臨床試驗中心協會(SocietyforClinicalResearchSites,SCRS...
FDA發布2兒科藥物草案:進行額外研究可延長6個月獨賣期!
2023-05-23 / 記者 巫芝岳
美國時間17日,美國食品藥物管理局(FDA)發布了兩項兒科藥物指南草案(draftguidances),鼓勵目前依據美國兩項兒科藥物法案取得批准的兒科藥物,若再進行額外的研究,可享有延長六個月獨賣期的優惠,但FDA也表示會對這些更從嚴審查。本次草案旨在讓根據《兒科研究權益法案》(PREA),申請延長六個月獨賣期時,FDA對於廠商提出的研究書面申請(WrittenRequests)能更嚴格嚴審查。而...
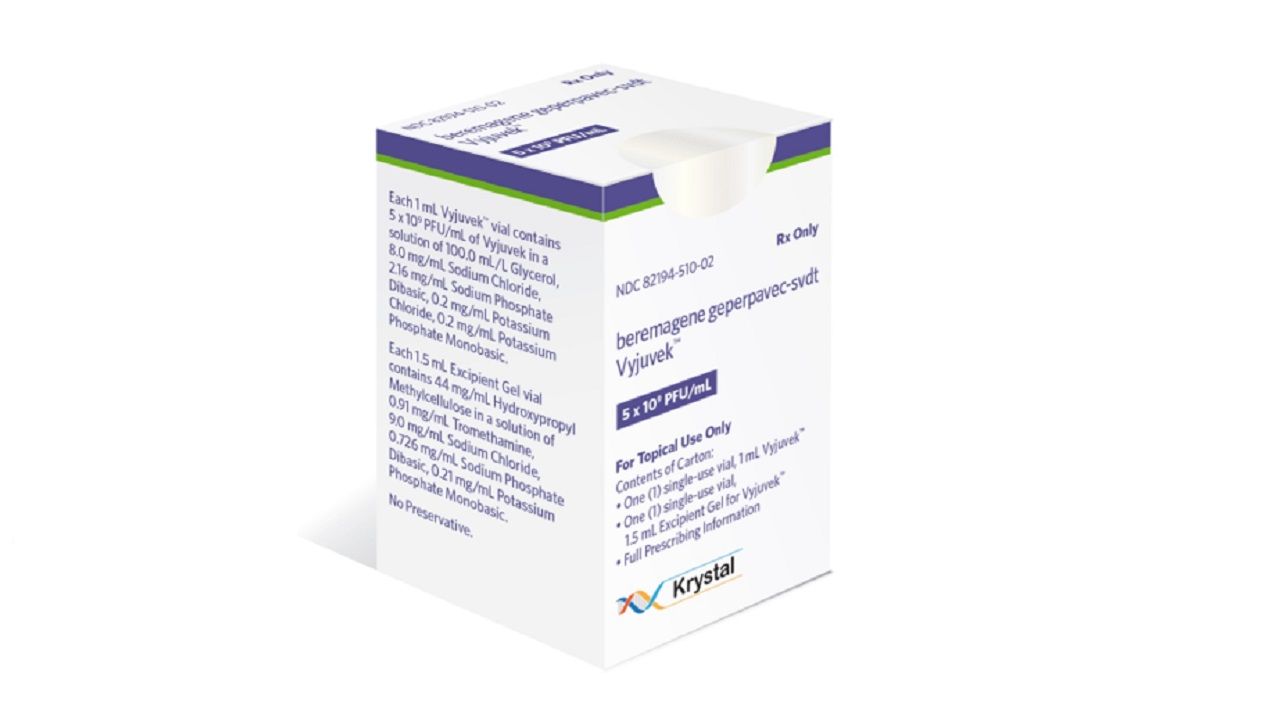
首款「外用」基因療法獲FDA批准! Krystal罕見皮膚療法7成傷口完全癒合
2023-05-22 / 記者 李林璦
美國時間19日,KrystalBiotech宣布,其基因療法Vyjuvek(beremagenegeperpavec)獲得美國食品藥物管理局(FDA)批准上市,用於治療6個月以上失養性表皮分解性水皰症(DEB)。這是首款針對遺傳性皮膚病患的外用基因療法,也是首款可重複給藥的基因療法。消息一出,Krystal股價上漲7%。 Vyjuvek的上市也代表著基於非腺相關病毒(AAV)載體基因療法的開發取得...
FDA發布「以患者為中心的藥物開發指南」 詳述如何訂定個人化臨床終點
2023-04-06 / 記者 李林璦
美國時間5日,美國食品藥物管理局(FDA)發布第四份「以患者為中心的藥物開發指南」,內容包含:臨床結果評估(COA)的臨床終點如何設定,以及如何收集與提交患者個人化的臨床試驗數據以便讓監管單位進行審查等。 COA的臨床終點設定在此次的指南中十分重要,FDA表示,COA的目的需直接或間接反映患者的感覺、功能或生存情況。但COA有很多該做和不該做的事情,經常讓廠商面臨挑戰,此次指南中也特別論述。 指南...