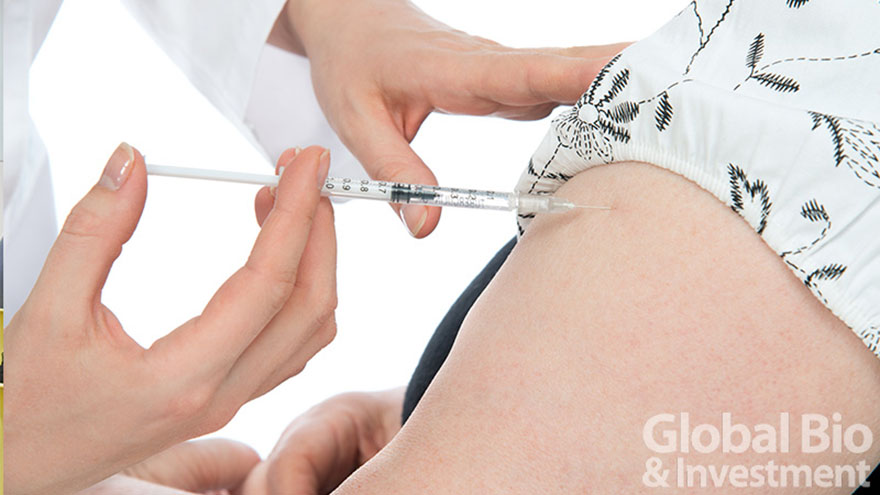
高端新冠疫苗啟動3700人二期試驗 全臺11間醫院共同參與
2021-01-06 / 記者 巫芝岳
報導/巫芝岳今(6)日,高端疫苗(6547)召開新冠疫苗臨床二期啟動會議,高端於去(2020)年12月29日取得衛福部試驗核准函後,已迅速啟動收案,總經理陳燦堅表示,二期試驗計畫收案超過3700名受試者,預計今年5、6月前完成試驗,同時配合政府的緊急使用授權(EUA)政策下,期望今年年中就能產出國產疫苗。總經理陳燦堅表示,二期試驗計畫收案超過3700名受試者,預計今年5、6月前完成試驗(攝影/巫芝...
FDA局長Stephen Hahn警告:無臨床數據 不可修改新冠疫苗施打劑量
2021-01-06 / 記者 李林璦
編譯/李林璦 曲速行動計畫(OperationWarpSpeed,OWS)的科學顧問MoncefSlaoui在4日表示,考慮將降低18-55歲成人施打Moderna的新冠肺炎疫苗劑量,以生產更多劑疫苗。5日,美國食品藥物監督管理局(FDA)發表聲明,警告醫療保健人員不要對疫苗劑量進行任何更改,否則會讓公眾健康陷入危險。 曲速行動計畫的科學顧問MoncefSlaoui在接受哥倫比亞廣播公司(CBS)...
曲速行動負責人:考量疫苗有效性 美國4月前不會批准AZ新冠疫苗
2021-01-04 / 記者 彭梓涵
編譯/彭梓涵 上週12月30日,英國政府領先全球,批准了阿斯特捷利康(AstraZeneca)與牛津大學的新冠疫苗。但就在英國政府批准後,美國曲速行動(WarpSpeed)負責人MoncefSlaoui表示,「美國不會在4月前批准該疫苗」。 阿斯特捷利康與牛津大學的新冠疫苗三期試驗,於去年(2020)11月的結果報告中,說明疫苗平均有效率達70%,低劑量小族群試驗中有效率更高達90%。 現任職於美...
中國國藥集團 新冠疫苗上市 保護率79.34%
2020-12-31 / 記者 李林璦
編譯/李林璦 今(31)日,中國國務院聯防聯控機制宣布,國藥集團(Sinopharm)中國生物北京公司的新冠減毒疫苗已獲得中國國家藥監局(NMPA)批准有條件上市。先前數據顯示,保護效力達79.34%,中和抗體陽轉率為99.52%,疫苗免疫的持久性和保護效果還需持續觀察。 在國務院聯防聯控機制新聞發佈會上,中國衛健委表示,目前已經啟動高風險族群疫苗接種。 中國生物北京公司於30日宣布,新冠病毒減...
拜登將動用《國防生產法》 加速新冠疫苗生產
2020-12-31 / 記者 李林璦
編譯/李林璦 美國時間29日,據外媒《CNBC》報導,美國總統當選人拜登(JoeBiden)計劃上任後援引《國防生產法》(DefenseProductionAct),提高新冠疫苗的產量。 拜登的新冠肺炎(COVID-19)顧問委員會的CelineGounder博士接受《CNBC》採訪時表示,拜登將下個月就職後,援引《國防生產法》以確保個人防護裝備(PPE)、檢測能力以及疫苗原料供應充足。 《國防...
第3款新冠疫苗出爐! 英批准牛津/AZ新冠疫苗
2020-12-30 / 記者 巫芝岳
編譯/巫芝岳今(30)日,英國政府宣布,已授予由牛津大學(OxfordUniversity)與阿斯特捷利康(AstraZeneca,AZ)共同開發的新冠疫苗緊急使用授權(EUA),比原先各界預期的2021年1月4日提早批准,也讓該疫苗成為繼輝瑞(Pfizer)/BioNTech、Moderna後,全球第三款獲得批准的新冠疫苗。據今日指揮中心公告台灣所洽購的疫苗中,也包含1千萬劑此疫苗。此項牛津/A...
美國加碼19.7億美元 訂購1億劑Moderna新冠疫苗
2020-12-30 / 記者 吳培安
編譯/吳培安繼美國時間11日,Moderna確認將提供2億劑新冠疫苗給美國政府後,又於29日宣布加碼19.7億美元,追加1億劑訂單,預計在2021年6月底全數出貨。該疫苗已經在本月18日取得FDA核准緊急使用授權(EUA)資格,同時也正在加拿大、歐盟、英國陸續審查中。 根據Moderna於11日透露的供貨時程,預計在今年底提供2000萬劑疫苗給美國政府,2021年第一季達成1億劑交付,第二季完成剩...
獲TFDA批准 高端疫苗啟動新冠疫苗臨床二期試驗
2020-12-30 / 記者 李林璦
報導/李林璦今(30)日,高端疫苗(6547)公告指出,已獲衛福部食品藥物管理署(TFDA)核准,進行新冠肺炎疫苗第二期人體臨床試驗。 高端的新冠疫苗開發案技轉自美國國衛院(NIH),建構以三聚體結構呈現的S-2P全長基因修飾重組棘蛋白作為疫苗抗原,並篩選出候選疫苗免疫組合物。 現已完成臨床前藥毒理試驗、倉鼠攻毒試驗,並完成第一期人體臨床試驗期中分析報告。 高端疫苗於2020年12月15日向TFD...
Novavax新冠疫苗啟動美國、墨西哥三期臨床 招募3萬人
2020-12-29 / 記者 劉端雅
編譯/劉端雅美國時間28日,美國國家衛生研究院(NIH)宣布,Novavax旗下候選疫苗NVX-CoV2373的三期臨床試驗,已經開始招募成年受試者,將在美國和墨西哥約115個地點招募約3萬人受試者,以評估該疫苗安全性和有效性。該試驗由NIH的國家過敏和傳染病研究所(NIAID)、美國生物醫學先進研究與開發局(BARDA)資助。NIAID主任AnthonyS.Fauci表示,這是在美國第五個COV...
INOVIO常溫保存DNA新冠疫苗 臨床1期:全數產生免疫反應
2020-12-28 / 記者 巫芝岳
編譯/巫芝岳近(24)日,美國生技公司INOVIO發表了其新冠肺炎候選DNA疫苗INO-4800的臨床1期數據,顯示注射2.0mg劑量組,全數受試者皆產生出免疫反應,研究結果發表於期刊《TheLancet》子刊《EClinicalMedicine》。而該疫苗不需冷凍保存,也是其最大的優勢之一。24日當天,INOVIO股價最大漲幅達8.3%。試驗結果顯示,該疫苗在所有受試者中皆具有免疫原性,可有效產...
《洛杉磯時報》Moderna、輝瑞新冠疫苗有效性分析一覽
2020-12-25 / 記者 吳培安
編譯/吳培安 近日,洛杉磯時報(LosAngelesTimes)針對兩家全球注目、美國FDA已批准緊急使用授權(EUA)的新冠肺炎疫苗開發商——Moderna和輝瑞(Pfizer),針對兩項疫苗產品的臨床試驗數據進行有效性評析,面相包括:整體有效性、老年族群、既病者(pre-existingmedicalcondition)、白人以外多元種族、性別、新冠肺炎重症、副作用多寡...
輝瑞/BioNTech新冠疫苗 美再購加1億劑 兩公司:將加量生產
2020-12-24 / 記者 巫芝岳
編譯/巫芝岳美國時間23日,輝瑞(Pfizer)宣布,川普政府將再多採購1億劑輝瑞/BioNTech的新冠疫苗,美國的總採購量目前達到2億劑;而兩公司也表示,比起原先承諾將在明年生產的13億劑疫苗,他們將再加量生產。根據協議,除了原先敲定的1億劑外,輝瑞/BioNTech已同意在明年7月31日前,向美國多提供另1億劑疫苗,而美國將為此多支付19.5億美元。迄今為止,輝瑞/BioNTech疫苗已可在...